
【题目】氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2·6H2O)的过程为:

已知:Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ. 有关氢氧化物开始沉淀和完全沉淀的pH如下表:
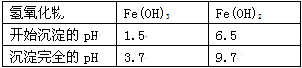
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是 。碳酸锶与盐酸反应的化学方程式为 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为__________。能否用新制氯水代替双氧水 (填“能”或“否”)。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为 。
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 。
(6)步骤⑥中,洗涤氯化锶晶体最好选用 。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
【答案】
(1)加快反应速率 SrCO3+2HCl=SrCl2+2H2O+CO2↑
(2)2Fe2++ H2O2 +2H+ = 2Fe3++ H2O; 能
(3)B EG
(4)Fe(OH)3、BaSO4
(5)温度高有利于除去湿存(晶体表面附着的)水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去
(6)D
【解析】
试题分析:以SrCO3为原料制备六水氯化锶(SrCl26H2O),由流程可知,SrCO3和盐酸反应后溶液中除含有Sr2+和Cl-外,还含有少量Fe2+、Ba2+杂质,然后加硫酸生成硫酸钡沉淀,加入过氧化氢,调节溶液pH可生成氢氧化铁沉淀,所以过滤后滤渣为硫酸钡和氢氧化铁,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl26H2O。
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是增大接触面积,加快反应速率。碳酸锶与盐酸反应的化学方程式为SrCO3+2HCl=SrCl2+2H2O+CO2↑。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,同时生成水,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,也可以用新制氯水代替双氧水。
(3)在步骤②~③的过程中,Fe2+被H2O2氧化为Fe3+,调节pH就是为了除去Fe3+,Fe3+完全沉淀的pH是3.7,所以应将溶液的pH值由1调节至大于3.7,但不能引入杂质,最好选用氢氧化锶粉末或者氧化锶粉末;
(4)碳酸锶中含少量钡的化合物,加入了稀硫酸,有硫酸钡生成,调节pH可生成氢氧化铁沉淀,所以操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4;
(5)六水氯化锶晶体61℃时开始失去结晶水,100℃时失去全部结晶水,则用热风吹干六水氯化锶,选择的适宜温度范围是50~60℃;
(6)步骤⑥中,洗涤氯化锶晶体最好选用酸溶液,抑制水解。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸:
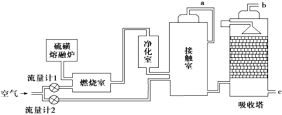
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面__________________________。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由环己烷可制得1,4-环己二醇,流程如下(其中无机产物都已略去),试回答:

(1)反应_________属于取代反应(填反应序号).
(2)化合物的结构简式:B______________,C_______________.
(3)反应⑥所用试剂和条件是________________________.
(4)写出反应②、⑤的化学方程式:反应②________________反应⑤__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2反应生成甲铵的能量变化如下图所示。
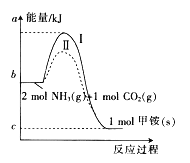
(1)图中反应为可逆反应,则生成甲铵的反应是 (填“放热”或“吸热”)反应。
(2)合成甲铵的热化学方程式为 。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,其原因是 。
(4)已知由甲铵合成尿素的反应为NH2COONH4(s)![]()
![]() ;
;![]() ,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为 。
,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如图所示。其中:A能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
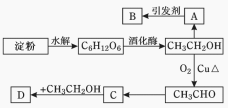
(1)C6H12O6的名称是________,A的电子式为_________,C中含有官能团名称 ;
(2)A→B反应类型____________;C→D反应类型____________。
(3)写出下列转化的化学方程式:
① A→B:______________________________________________________;
② A→CH3CH2OH:______________________________________;
③ C→D:_____________________________________________________;
④ CH3CH2OH→CH3CHO:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答问题:
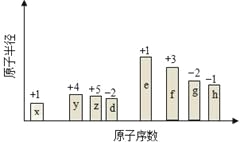
(1)f在元素周期表的位置是____________________________。
(2)比较d、e常见离子的半径大小______>______(用化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性强弱___________>____________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式______________________。
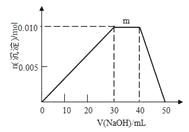
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1 mol·L-1 R溶液的烧杯中滴加1 mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化如图所示。
① 写出m段反应的离子方程式_______________________________。
② 若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
![]()
则x= 。
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g) ![]() HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时v(HCOOCH3)= 。
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) = 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正) v(逆)(填“﹥”“﹤”“﹦”),原因是 。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“﹥”“﹤”“﹦”),判断的理由是 。
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
NO+CO![]() N2+ CO2(有CO) 2NO
N2+ CO2(有CO) 2NO![]() N2+ O2(无CO)
N2+ O2(无CO)
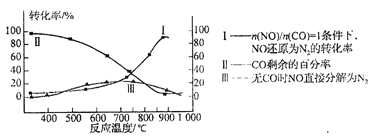
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 。
②在n(NO)/ n(CO)=1的条件下,应控制最佳温度在 左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
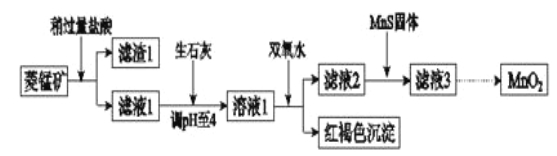
已知:生成氢氧化物沉淀的pH
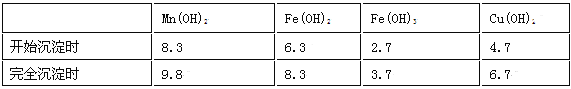
注:金属离子的起始浓度为0.1 mol/L,回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 _______ ___________ 。盐酸溶解MnCO3的化学方程式是_______ ______________ ___ _____。
(2)向溶液1中加入双氧水时,反应的离子方程式是 _______ ___________ 。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是 ________ 。
(4)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□________=□________+□________+□________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 阳极生成MnO2的电极反应式是 ____ ___ ____________ _______ 。
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是 _____ 。
③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是 ___ __ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72–的酸性废水通过铁炭混合物,在微电池正极上Cr2O72–转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。
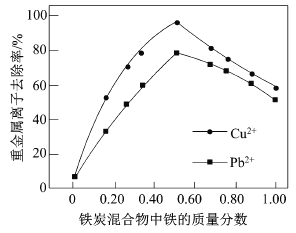
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4–(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3–+10H+===4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见图),产生该差异的可能原因是 。
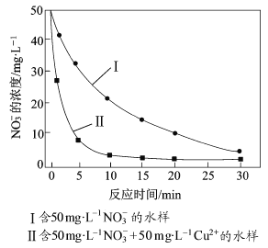
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com