
【题目】
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
① 1 mol PAN中含有的σ键数目为________。PAN中四种元素的第一电离能由大到小的顺序为________________。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中的中心离子的配位数为________,中心离子的核外电子排布式为________________________。
③ 相同压强下,乙醇的沸点比CH3OCH3________(填“高”或“低”),其原因是_____________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
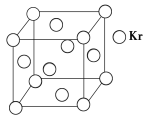
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=____________(填数字)。
【答案】10NA (或6.02×1024) N>O>C>H 6 1s22s22p63s23p63d6(或[Ar]3d6) 高 乙醇分子间能形成氢键 de 正四面体形 sp2 3
【解析】
(1)①一个单键就是一个σ键,一个双键中含有一个σ键,一个π键;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,据此答题;
②配位体位于方括号中,由1个NO和5个H20分子构成;中心离子为Fe2+,铁是26号元素,所以Fe2+的电子排布式为1s22s22p63s23p63d6,据此答题;
③乙醇分子间能形成氢键,CH3OCH3不能形成分子间氢键,所以相同压强下,乙醇的沸点比CH3OCH3高。据此答题;
(2)①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,其中铵根离子内部含一个配位键;
②NH4+的中心原子氮原子价层电子对数=(5+4-1)/2=4,孤电子对=(5-1×4-1)/2=0,所以NH4+的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=(5+1)/2=3,所以氮原子按sp2方式杂化,据此判断;
(3)Kr晶胞为面心立方密堆积,以顶点Kr原子为研究对象,与之紧相邻的Kr原子处于面心,每个顶点Kr原子为8个晶胞共有,每个晶胞上有3个面心Kr原子与之紧相邻,每个面心Kr原子为2个晶胞共用,与每个Kr原子紧邻的Kr原子有3×8/2=12;晶胞中含Kr原子为8×1/8+6×1/2=4,则m:n=12:4=3,然后求出比值。
(1)①一个单键就是一个σ键,一个双键中含有一个σ键,一个π键,![]() 中共有10个共价键,所以1molPAN中含有的σ键数目为10NA;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,即N>O>C>H。本小题答案为:10NA (或6.02×1024;N>O>C>H。
中共有10个共价键,所以1molPAN中含有的σ键数目为10NA;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,即N>O>C>H。本小题答案为:10NA (或6.02×1024;N>O>C>H。
②配位体位于方括号中,由1个NO和5个H2O分子构成;中心离子为Fe2+,配位数为6;铁是26号元素,所以Fe2+的电子排布式为1s22s22p63s23p63d6。本小题答案为:6 ;1s22s22p63s23p63d6(或[Ar]3d6)。
③乙醇分子间能形成氢键,CH3OCH3不能形成分子间氢键,所以相同压强下,乙醇的沸点比CH3OCH3高。本小题答案为:高;乙醇分子间能形成氢键。
(2)①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,其中铵根离子内部含一个配位键。本小题答案为:de。
②NH4+的中心原子氮原子价层电子对数=(5+4-1)/2=4,孤电子对=(5-1×4-1)/2=0,所以NH4+的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=(5+1)/2=3,所以氮原子按sp2方式杂化。本小题答案为:正四面体形;sp2。
(3)Kr晶胞为面心立方密堆积,以顶点Kr原子为研究对象,与之紧相邻的Kr原子处于面心,每个顶点Kr原子为8个晶胞共有,每个晶胞上有3个面心Kr原子与之紧相邻,每个面心Kr原子为2个晶胞共用,与每个Kr原子紧邻的Kr原子有3×8/2=12;晶胞中含Kr原子为8×1/8+6×1/2=4,则m:n=12:4=3。本小题答案为:3。


科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
(1)某学生在实验室用密度为1.15g/mL,质量分数为15%的工业品过氧乙酸配制0.1mol/L过氧乙酸溶液250mL,该生用量筒量取工业品过氧乙酸体积___________________ mL,除量筒、玻璃棒、烧杯外还需要的其它仪器是__________________________________________________________________________。
(2)该学生配制前设计了下列操作,其合理的操作顺序是___________________________________________(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需体积的工业品过氧乙酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的工业品过氧乙酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,倒置并振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(选填“偏高” 、“ 偏低”或“无影响”)?
a. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水_____________________;
b. 转移溶液时,不慎有少量溶液洒在容量瓶外___________________________;
c.量取15%的工业品过氧乙酸时,仰视量筒___________________________________;
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线____________。
(4)下列叙述正确的是__________________(填字母)。
A.可用过滤的方法将过氧乙酸溶液中混有的NaCl除掉
B.过氧乙酸包装上应贴的危险警告标签应如右图所示
C.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
D.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_________________________________________________________________________________________。
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-请选择下列试剂按照加入先后顺序填空_________________________(试剂不必选完,填序号)。
①盐酸②醋酸钡溶液③氯化钡溶液④醋酸⑤碳酸钠溶液⑥碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
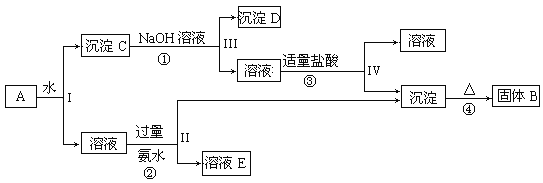
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是___________。
(2)写出①、②、③离子方程式④化学反应方程式
①____________________________;②___________________________;
③____________________________;④____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用200 mL 1 mol/L 氯化铝溶液与一定量 3 mol/L的氢氧化钠溶液混合,可得到氢氧化铝7.8g,请计算需要此氢氧化钠溶液的体积为多少毫升?(写计算步骤)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
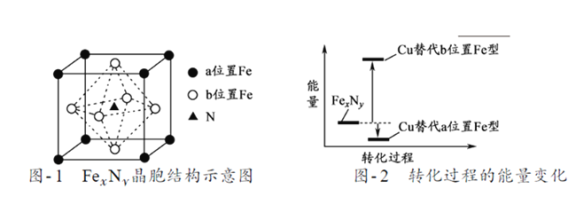
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图。根据图示转化关系回答:

(1)写出下列物质的化学式。
A________,B________,甲_________,乙________。
(2)写出下列变化的化学方程式。
①A与NaOH溶液反应的化学方程式________________________________。
②甲与NaOH溶液反应的离子方程式________________________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期四种主族元素X、Y、Z、Q在周期表中的位置如图所示。X、Y、W的最外层电子数之和与Q原子核内质子数相等。下列说法中不正确的是( )
X | Y | ||
Z | Q | ||
W |
A. 离子半径![]() :r(Wm-)>r(Qm-)>r(Zn-)
:r(Wm-)>r(Qm-)>r(Zn-)
B. 元素Z和Y的化合价都可能存在![]() 价
价
C. 可以推测HWO4是W的最高价氧化物的水化物
D. X元素的氢化物种类繁多,大多可以与W元素的单质发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 硫酸、盐酸、氢氟酸均为强酸
D. 氯水、水玻璃、氨水均为混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com