
【题目】下列有关物质的分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 硫酸、盐酸、氢氟酸均为强酸
D. 氯水、水玻璃、氨水均为混合物
【答案】D
【解析】
在进行分类前先确立分类“标准”,由此分析。
A.CO不能与碱反应生成盐和水,也不能与水化合生成对应价态的含氧酸,所以CO不属于酸性氧化物,A项错误;
B.根据分散质粒子直径将分散系分为溶液、胶体和浊液,氯化铁溶液属于溶液,硅酸属于纯净物,所以硅酸和氯化铁溶液都不是胶体,B项错误;
C.强酸属于强电解质,在水溶液中完全电离,而氢氟酸在水溶液中只能部分电离:HF![]() H++F-,所以氢氟酸不属于强酸,C项错误;
H++F-,所以氢氟酸不属于强酸,C项错误;
D.混合物是指含有2种或2种以上成分的物质。氯水是氯气的水溶液,水玻璃是Na2SiO3的水溶液,氨水是NH3的水溶液,所以氯水、水玻璃、氨水都是混合物,D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】如图表示不同物质之间的关系,下列说法正确的是

A. 若a表示化合物,b表示脂质,c表示固醇,则甲可以表示细胞中的物质
B. 若a表示核酸,b表示RNA,则c可以表示A、C、G、T四种含氮碱基
C. 若a表示糖类,b表示二糖,则c可以表示纤维素
D. 若a表示蛋白质,则b可表示酶,c可以表示胃蛋白酶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
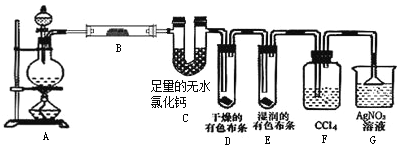
(1)写出A中实验室制氯气的化学方程式________。
(2)①装置B中盛放的试剂名称为________,现象是________。
②装置D和E中出现的不同现象说明________。
③装置F的作用是________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在装置F和装置G之间再加一个装置,该装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某电解精炼铜的阳极泥经预处理后主要含有TeO2和少量Ag、Au,以此预处理阳极泥为原料制备单质碲的一种工艺流程如下:

已知TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱分别生成Te4+和TeO32-。回答下列问题:
(1)阳极泥预处理时发生反应: Cu2Te+O2→CuO+TeO2,Cu2Te中Te的化合价为_____,该反应中氧化剂与还原剂的物质的量之比为_________。
(2)“过滤I”所得滤液中,阴离子主要有_______,要从滤渣1中分离出Au,可以向滤渣中加入的试剂是_________。
(3)步骤②控制溶液的pH为4.5~5.0,反应的化学方程式为________,防止酸度局部过大的操作是____________。
(4)步骤④发生反应的离子方程式是____________。
(5)高纯碲的制备采用电解精炼法。将上述流程得到的粗碲溶于NaOH溶液配成电解液,用适当的电极进行电解,阳极产生的气体是____,阴极上的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关葡萄糖的说法正确的是( )。
A. 蔗糖、麦芽糖水解都只生成葡萄糖 B. 葡萄糖与果糖互为同分异构体
C. 用银氨溶液可以检验葡萄糖和麦芽糖 D. 葡萄糖、乙酸乙酯和乙酸的最简式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2) / mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列说法正确的是
A. 0~2 min内的平均速率为υ (CO)=0.6 mol/(L·min)
B. 4 min后,平衡移动的原因可能是再向容器中加入了2.0 mol的SO2
C. 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D. 若其他条件不变,起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向2.0 L恒容密闭容器中充入2.08 mol PCl5,反应PCl5(g) ![]() PCl3(g) + Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g) + Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 56 | 0. 75 | 0. 80 | 0. 80 |
回答下列问题:
(1)反应在前50 s 的平均速率v(PCl3)= _______mol/( L·s) 。
(2)T℃时,起始时向容器中充入1. 2 mol PCl5、0. 40 mol PCl3 和0. 20 mol Cl2,反应达到平衡前v(正)__________(选填“>”、“=”或“ <”)v(逆) 。
(3)T℃时,若起始时向容器中充入6. 0 mol PCl3 和6. 0 mol Cl2,达到平衡时,平衡混合气体中PCl5的体积分数为多少?(写出解题过程)。_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com