
����Ŀ��ijУ��ѧʵ����ȤС��Ϊ��̽����ʵ�����Ʊ�Cl2�Ĺ�������ˮ������HCl�ӷ�������ͬʱ֤��������ijЩ���ʣ���ͬѧ�������ͼ��ʾ��ʵ��װ�ã�֧���õ�����̨ʡ�ԣ�����Ҫ��ش����⡣
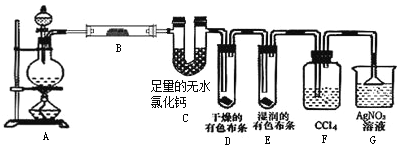
��1��д��A��ʵ�����������Ļ�ѧ����ʽ________��
��2����װ��B��ʢ�ŵ��Լ�����Ϊ________��������________��
��װ��D��E�г��ֵIJ�ͬ����˵��________��
��װ��F��������________��
��3����ͬѧ��Ϊ��ͬѧ��ʵ����ȱ�ݣ�����ȷ������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�Ϊ��ȷ��ʵ����۵Ŀɿ��ԣ�֤������ͨ��AgNO3��Һ������ֻ��һ�֣���ͬѧ�����װ��F��װ��G֮���ټ�һ��װ�ã���װ����Ӧ����________����д�Լ�����Ʒ���ƣ���
���𰸡�MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O ��ˮ����ͭ ��ɫ�����Ϊ��ɫ ������Ư���ԣ�ʪ���������Ư���ԣ����������Ư���ԣ� �������� ʪ��ĵ���KI��ֽ����ʪ�����ɫ������
MnCl2+Cl2��+2H2O ��ˮ����ͭ ��ɫ�����Ϊ��ɫ ������Ư���ԣ�ʪ���������Ư���ԣ����������Ư���ԣ� �������� ʪ��ĵ���KI��ֽ����ʪ�����ɫ������
��������
��1��ʵ�����ö���������Ũ���ᷴӦ�Ʊ�������
��2����������ˮ����ͭ����ˮ�������ʼ����������Ƿ���ˮ������
�����ݸ������ɫ��������ɫ��ʪ�����ɫ������ɫ���Ա�˵������Ư���ԵIJ���������
������������CCl4��
��3��Gװ������������HCl����ģ�Ϊȷ��ʵ����۵Ŀɿ��ԣ���Ҫ�ų������ĸ��ţ������������⻯�صõ����ʵ⣬������۱������ݴ�������
A.ʵ��ʱ�ö���������Ũ�����ڼ��������·�Ӧ���Ʊ������������Ȼ��̡�ˮ����������Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��2����Ϊ��̽����ʵ�����Ʊ�Cl2�Ĺ�������ˮ������������B�м�����ˮ����ͭ��������������֤�������к���ˮ������
�ʴ�Ϊ����ˮ����ͭ����ɫ�����Ϊ��ɫ��
�ڸ������ɫ��������ɫ��ʪ�����ɫ������ɫ��˵������Ư���ԵIJ���������������ˮ�еĴ����ᣬ
�ʴ�Ϊ��������Ư���ԣ�ʪ���������Ư���ԣ����������Ư���ԣ���
������������CCl4�����Ը�װ�õ�����������������
�ʴ�Ϊ������������
��3��Gװ����������HCl���壬Ϊ��ȷ��ʵ����۵Ŀɿ��ԣ�Ӧ�ų������ĸ��ţ���F��������֮��Ҫ���������Ƿ���ȫ��ȥ��������������ǿ�����Ե����ʣ�����ʪ��ĵ���KI��ֽ���飬�䷴Ӧ����ʽΪ��Cl2+2KI=2KCl+I2�����ɵĵ������۱������粻��ɫ��˵���Ѿ���ȫ��ȥ�����Կ�����F��G֮������һ��ʢ��ʪ��ĵ��۵⻯����ֽ��ϴ��ƿ�����Ƿ�����������������������Ư���ԣ�Ҳ����F��G֮������һ��ʢ��ʪ�����ɫ������ϴ��ƿ��������ɫ����֤�������ѱ���ȫ�������˷���Ҳ������
�ʴ�Ϊ��ʪ��ĵ���KI��ֽ����ʪ�����ɫ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪT1ʱ���������ݻ���Ϊ1L�ĺ����ܱ������н�������Ӧ��2NO2(g)![]() 2NO(g)+O2(g)����������±���ʾ������˵����������� ��
2NO(g)+O2(g)����������±���ʾ������˵����������� ��
���� ��� | ���ʵ���ʼŨ�� (mol��L-1) | ���ʵ�ƽ��Ũ�� (mol��L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
�� | 0.6 | 0 | 0 | 0.2 |
�� | 0.3 | 0.5 | 0.2 | |
�� | 0 | 0.5 | 0.35 | |
A. �������з�����Ӧ��ƽ�ⳣ��Ϊ0.8 B. �������з�����Ӧ����ʼ����v��>v��
C. �ﵽƽ��ʱ����������![]() >1 D. �ﵽƽ��ʱ�����������������е���ѹǿ֮��Ϊ16��17
>1 D. �ﵽƽ��ʱ�����������������е���ѹǿ֮��Ϊ16��17
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ������ȷ����ǣ� ��
������� | ������ | ����� | ���������� | ���������� |
A. | Ư�� | ��ˮ | ������̼ | ������ |
B. | �ɱ� | ̼��� | һ������ | ���������� |
C. | CaCl2��8NH3 | ˮ | �������� | �������� |
D. | Һ�� | �Ȼ��� | �������� | ������ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н������з�Ӧ CO2��g�� + C��s��![]() 2CO��g�� ��H >0 �ﵽƽ���,�ı���������,����ָ�����ʵ�Ũ�ȼ�ƽ����α仯:
2CO��g�� ��H >0 �ﵽƽ���,�ı���������,����ָ�����ʵ�Ũ�ȼ�ƽ����α仯:
��1������C���� ,ƽ��______________���������Ӧ�����ƶ��������淴Ӧ�����ƶ������ƶ��� ����ͬ����c��CO��_______ �������С�����䡱����ͬ��
��2����С�ܱ����������,�����¶Ȳ���, ��ƽ��_____________,c��CO2��________��
��3��ͨ��N2,�����ܱ�����������¶Ȳ���, ��ƽ��___________,c��CO2��________��
��4�������ܱ������������,�����¶�, ��ƽ��______________, c��CO��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ж�������������Ũ��ˮ����ܵ��Ƿ�©������������й©�����ڹܵ���Χ�����������̣���Ӧ�Ļ�ѧ����ʽΪ��3Cl2��8NH3��6NH4Cl��N2
��1����˫���ŷ�����������Ӧ��ֻ��������ת�Ƶķ������Ŀ��________��
��2��������Ӧ�У��������Ļ�ѧʽ��________��������________��Ӧ����д����������ԭ������
��3��������Ӧ�У��������뻹ԭ�������ʵ���֮����________��
��4������Ӧ��ת����1.2 mol���ӣ������������ڱ�״���µ����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ����Դ�������йؽ������仯�����˵��������ǣ� ��
A.�������MgCl2�Ʊ�Mg
B.�Ѻ��ѺϽ���Ϊ��21�������з�չǰ���Ľ�������������Ҫ���������ɻ�����������
C.�����Ըֹ�ǿ�ȡ����Ժ��ӹ�Ҫ��ܸߣ��ʺ��������ֹ������̼��
D.��ΪAl2O3��Ӳ�Ⱥܴ����Կ������������²���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵķ�����ȷ���ǣ�������
A. SO2��SiO2��CO������������
B. ϡ���������ᡢ�Ȼ�����Һ��Ϊ����
C. ���ᡢ���ᡢ������Ϊǿ��
D. ��ˮ��ˮ��������ˮ��Ϊ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���10 mL 0.40 mol/L H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��������ʾ����Ӧ���������У�
��2Fe3++ H2O2 ![]() 2Fe2++ O2��+ 2H+���� H2O2 + 2Fe2+ + 2H+
2Fe2++ O2��+ 2H+���� H2O2 + 2Fe2+ + 2H+ ![]() 2Fe3++2H2O��
2Fe3++2H2O��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
��Ӧ�����������仯����ͼ��ʾ��

����˵������ȷ����
A. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2) = 3.33��10-2 mol/( L��min)
B. Fe3+�������������������ķֽ�����
C. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
D. ��Ӧ2H2O2(aq) ![]() 2H2O(l) + O2(g)����H > 0
2H2O(l) + O2(g)����H > 0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������
A.ͨ������£������ǿ�ᡢǿ�ǿ����������Ӧ
B.�����ʵ����ļ�������������ȡ����Ӧ��������һ�ȼ�������ʵ������
C.������ȴ��ﶼ������ˮ
D.�����¼�������������ȡ����Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com