
【题目】在密闭容器中进行下列反应 CO2(g) + C(s)![]() 2CO(g) △H >0 达到平衡后,改变下列条件,分析指定物质的浓度及平衡如何变化:
2CO(g) △H >0 达到平衡后,改变下列条件,分析指定物质的浓度及平衡如何变化:
(1)增加C的量 ,平衡______________(填“向正反应方向移动”或“向逆反应方向移动”或“不移动” ;下同),c(CO)_______ (填“增大”或“减小”或“不变”;下同)
(2)减小密闭容器的体积,保持温度不变, 则平衡_____________,c(CO2)________。
(3)通入N2,保持密闭容器体积和温度不变, 则平衡___________,c(CO2)________。
(4)保持密闭容器体积不变,升高温度, 则平衡______________, c(CO)_________。
【答案】 不移动 不变 向逆反应方向移动 增大 不移动 不变 向正反应方向移动 增大
【解析】(1)C为固体,增大C的量,平衡不移动,c(CO)不变,故答案为:不移动;不变;
(2)正反应为气体体积增大的反应,保持温度不变,缩小反应容器的容积,压强增大,平衡向逆反应方向移动,c(CO2)增大,故答案为:向逆反应方向移动;增大;
(3)保持反应容器的容积和温度不变,通入N2,反应混合物各组分的浓度不变,平衡不移动,c(CO2)不变,故答案为:不移动;不变;
(4)正反应为吸热反应,保持反应容器的容积不变,升高温度,平衡向正反应方向移动,c(CO)增大,故答案为:向正反应方向移动;增大。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量(Hg2+等)重金属化合物杂质。黄铁矿的主要成分是FeS2,还含有SiO2和Al2O3等杂质。工业上采用同槽硫酸酸溶等工艺制备碳酸锰并回收硫酸铵,其主要流程如下:( 已知: Ksp[Al(OH) 3]=1 3×10-33,Ksp[Fe(OH) 3]=5.3×10-38,金属离子的浓度小于1×10-6视为沉淀完全。)

(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:
①适当升高温度,②搅拌,③_________________等。
(2)流程“氧化”中加入MnO2与Fe2+发生反应的离子方程式为_________________。
(3)“滤渣2”中主要成分的化学式为_________________。
(4)流程“除重金属”时使用(NH4)2S而不使用Na2S的原因是_________________。
(5)流程“50℃碳化”得到碳酸锰,该反应的化学方程式为_________________。
(6)生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是金属,若把X浸入Z的硝酸盐溶液中,X的表面有Z析出;若X、Y和盐酸形成原电池,Y为电池的负极。则X、Y、Z的金属活动性顺序为( )
A.Y>X>ZB.X>Z>YC.X>Y>ZD.Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠。实验装置如图所示。

(1)乙中盛装的试剂是_________;烧杯(丁)中稀硫酸的作用是_________________________;实验结束后,通过,_________操作分离出NaHCO3晶体。
(2)单独将CO2通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的_________性,丙中发生的反应方程式为______________________________________。
(3)将所得NaHCO3洗涤灼烧后得到碳酸钠。验证产品中是否混有NaCl的方法是_________________。
(4)为测定NaHCO3含量,称取5.000g试样,配制成100mL溶液,用标准盐酸滴定,测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol·L-1盐酸的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
第二次 | 20.00 | 如下图 | 如下图 |
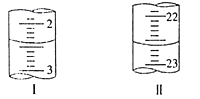
若以甲基橙为指示剂,在滴定终点时的颜色变化为___________________________________,该实验测定NaHCO3含量为w(NaHCO3)=_________(小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,11.2 L Cl 2 所含有的原子数目为NA
B. 常温常压下,18 g H2O 中含有的电子数目为2 NA
C. 足量的铁在0.1 mol Cl2 燃烧时转移的电子数目为0.3 NA
D. 2.0 L 0.5 mol·L-1 MgSO4溶液中含有的SO42-数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
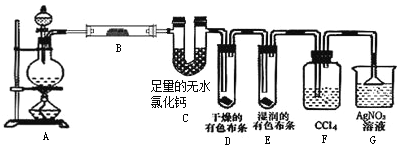
(1)写出A中实验室制氯气的化学方程式________。
(2)①装置B中盛放的试剂名称为________,现象是________。
②装置D和E中出现的不同现象说明________。
③装置F的作用是________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在装置F和装置G之间再加一个装置,该装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某电解精炼铜的阳极泥经预处理后主要含有TeO2和少量Ag、Au,以此预处理阳极泥为原料制备单质碲的一种工艺流程如下:

已知TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱分别生成Te4+和TeO32-。回答下列问题:
(1)阳极泥预处理时发生反应: Cu2Te+O2→CuO+TeO2,Cu2Te中Te的化合价为_____,该反应中氧化剂与还原剂的物质的量之比为_________。
(2)“过滤I”所得滤液中,阴离子主要有_______,要从滤渣1中分离出Au,可以向滤渣中加入的试剂是_________。
(3)步骤②控制溶液的pH为4.5~5.0,反应的化学方程式为________,防止酸度局部过大的操作是____________。
(4)步骤④发生反应的离子方程式是____________。
(5)高纯碲的制备采用电解精炼法。将上述流程得到的粗碲溶于NaOH溶液配成电解液,用适当的电极进行电解,阳极产生的气体是____,阴极上的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)0.2 g H2含有________个H原子。
(2)12.4克Na2X中含有0.4molNa+,则Na2X的摩尔质量是_________。
II.如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
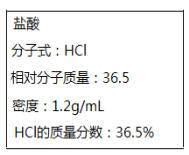
(1)求原浓盐酸的物质的量浓度c=____________。
(2)计算出m=___________。
(3)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com