
【题目】一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠。实验装置如图所示。

(1)乙中盛装的试剂是_________;烧杯(丁)中稀硫酸的作用是_________________________;实验结束后,通过,_________操作分离出NaHCO3晶体。
(2)单独将CO2通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的_________性,丙中发生的反应方程式为______________________________________。
(3)将所得NaHCO3洗涤灼烧后得到碳酸钠。验证产品中是否混有NaCl的方法是_________________。
(4)为测定NaHCO3含量,称取5.000g试样,配制成100mL溶液,用标准盐酸滴定,测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol·L-1盐酸的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
第二次 | 20.00 | 如下图 | 如下图 |
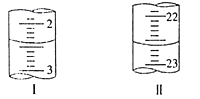
若以甲基橙为指示剂,在滴定终点时的颜色变化为___________________________________,该实验测定NaHCO3含量为w(NaHCO3)=_________(小数点后保留两位)。
【答案】 饱和NaHCO3溶液 吸收可能逸出的氨气,防止污染环境 过滤 碱 CO2+NH3+NaCl+H2O=NH4Cl+NaHCO3↓(或分两步写) 取少量样品于洁净试管中,加水溶解,稀硝酸酸化后滴加AgNO3 溶液,若有白色沉淀产生,则说明混有NaCl,反之则无(或其他合理答案) 由黄色变为橙色 84.42%
【解析】试题分析:本题考查NaHCO3的制备、物质的检验、滴定实验、NaHCO3含量的测定。
(1)甲装置为CO2的发生装置,由于盐酸具有挥发性,制得的CO2中混有HCl和H2O(g),HCl会与NH3反应生成NH4Cl,乙中盛装的试剂用于除去HCl,乙中盛装的试剂是饱和NaHCO3溶液;装置丙中发生反应NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;烧杯丁中稀硫酸的作用是:吸收可能逸出的NH3,防止污染环境。实验结束后,通过过滤操作分离出NaHCO3晶体。
(2)单独将CO2通入饱和食盐水中不可能产生NaHCO3沉淀,CO2通入饱和氨化食盐水中,NH3与CO2、H2O作用生成NH4HCO3(NH3+H2O+CO2=NH4HCO3),NH3在此的作用主要基于NH3的碱性。丙中发生反应的化学方程式为NH3+H2O+CO2=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl,总反应的化学方程式为NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。
(3)检验产品中是否混有NaCl即检验Cl-,方法是:取少量样品于洁净试管中,加水溶解,稀硝酸酸化后滴加AgNO3 溶液,若有白色沉淀产生,则说明混有NaCl,反之则无。
(4)甲基橙的变色范围为3.1~4.4,以甲基橙为指示剂,滴定终点的颜色变化为:溶液由黄色变为橙色。第一次实验消耗盐酸溶液的体积为21.00mL-1.00mL=20.00mL;第二次实验的初读数为2.40mL,终读数为22.60mL,第二次实验消耗盐酸溶液的体积为22.60mL-2.40mL=20.20mL;两次实验消耗盐酸溶液体积的平均值为![]() =20.10mL;根据反应NaHCO3+HCl=NaCl+H2O+CO2↑,20.00mL待测液中n(NaHCO3)=n(HCl)=0.5000mol/L
=20.10mL;根据反应NaHCO3+HCl=NaCl+H2O+CO2↑,20.00mL待测液中n(NaHCO3)=n(HCl)=0.5000mol/L![]() 20.10
20.10![]() 10-3L=1.005
10-3L=1.005![]() 10-2mol;5.000g试样中n(NaHCO3)=1.005
10-2mol;5.000g试样中n(NaHCO3)=1.005![]() 10-2mol
10-2mol![]() =0.05025mol,m(NaHCO3)=0.05025mol
=0.05025mol,m(NaHCO3)=0.05025mol![]() 84g/mol=4.221g,ω(NaHCO3)=
84g/mol=4.221g,ω(NaHCO3)=![]() 100%=84.42%。
100%=84.42%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某探究性学习实验小组做了如下实验:
实验一:利用H2C2O4 溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 试验温度/K | 溶液颜色褪至无色时所需时间/s | |||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 5 | 0.1 | 3 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 5 | t1 |
(1)通过实验A、B,可探究出_____________ (填外部因素)的改变对反应速率的影响,其中V1=__________,T1=__________;通过实验__________可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由此实验可以得出的结论是_______________;利用实验B 中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4span>)= __________。
实验二:探究酸的强弱对酸与镁条反应速率的影响。
实验步骤:


(a)检查装置的气密性后,添加药品;
(b)反应开始后,每隔1min记录一次生成H2的体积;
(c)将所记录的数据转化为曲线图(上图乙)。
(3)根据反应的图像(图乙)分析:0-lmin盐酸与镁反应比1-2min反应快的原因:_____________。
(4)对照实验:用20mL水代替酸进行实验。
实验现象:当水滴入锥形瓶中,注射器的活塞_________(填“会”或“不会”)向右移动。
问题分析:针对上述现象,上图中气体发生装置是否合理:_______(填“合理”或“不合理”)若合理,则忽略下问;若不合理,请改进上述装置使其变成合理的装置图:_____________ (用必要的文字或装置图进行回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关自然资源的开发利用的叙述正确的是( )
A.通过催化重整,可从石油中获取环状烃
B.裂化汽油可用于萃取溴水中的溴
C.石油的裂化和裂解属于化学变化而煤的液化、气化属于物理变化
D.煤中含有大量的苯、甲苯、二甲苯等有机物,可通过煤的干馏来提取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A. 反应②为反应③提供了原料
B. 反应②也是SO2资源利用的方法之一
C. 制得等量H2所需能量较少的是系统(I)
D. 系统(I)制氢的热化学方程式为H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
分类组合 | 纯净物 | 电解质 | 酸性氧化物 | 碱性氧化物 |
A. | 漂白粉 | 氨水 | 二氧化碳 | 氧化铝 |
B. | 干冰 | 碳酸钙 | 一氧化氮 | 四氧化三铁 |
C. | CaCl2·8NH3 | 水 | 三氧化硫 | 过氧化钠 |
D. | 液氨 | 氯化氢 | 二氧化硅 | 氧化钙 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa,298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A. H2O(g) = H2(g) + ![]() O2 (g) △H = +242 kJ/mol
O2 (g) △H = +242 kJ/mol
B. 2H2(g) + O2 (g) = 2H2O (l) △H = -484 kJ/mol
C. H2 (g) + ![]() O2 (g) = H2O (l) △H = -242 kJ/mol
O2 (g) = H2O (l) △H = -242 kJ/mol
D. 2H2 (g) + O2 (g) = 2H2O (g) △H = +484 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应 CO2(g) + C(s)![]() 2CO(g) △H >0 达到平衡后,改变下列条件,分析指定物质的浓度及平衡如何变化:
2CO(g) △H >0 达到平衡后,改变下列条件,分析指定物质的浓度及平衡如何变化:
(1)增加C的量 ,平衡______________(填“向正反应方向移动”或“向逆反应方向移动”或“不移动” ;下同),c(CO)_______ (填“增大”或“减小”或“不变”;下同)
(2)减小密闭容器的体积,保持温度不变, 则平衡_____________,c(CO2)________。
(3)通入N2,保持密闭容器体积和温度不变, 则平衡___________,c(CO2)________。
(4)保持密闭容器体积不变,升高温度, 则平衡______________, c(CO)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是重要的资源,下面有关金属及其化合物的说法错误的是( )
A.电解熔融MgCl2制备Mg
B.钛和钛合金被誉为“21世纪最有发展前景的金属材料”,主要用来制作飞机发动机部件
C.高铁对钢轨强度、韧性和易加工要求很高,适合做高铁钢轨的是中碳钢
D.因为Al2O3的硬度很大,所以可用于制造耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】14g铜金合金与足量的某浓度HNO3反应,将产生的气体用2.24L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为( )
A.9.6gB.6.4gC.12.8gD.1.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com