
【题目】I.(1)0.2 g H2含有________个H原子。
(2)12.4克Na2X中含有0.4molNa+,则Na2X的摩尔质量是_________。
II.如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
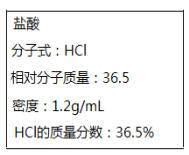
(1)求原浓盐酸的物质的量浓度c=____________。
(2)计算出m=___________。
(3)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
【答案】1.204×1023 62g/mol 12mol/L 3.9g 200
【解析】
I.(1)1个氢气分子中含2个H原子;
(2)12.4克Na2X中含有0.4molNa+,根据Na2X的组成计算出Na2X的物质的量及摩尔质量,根据摩尔质量与相对分子量的关系计算出X的相对原子质量;
II. (1)根据浓盐酸试剂瓶标签数据计算出物质的量浓度;
(2)根据锌和盐酸反应方程式计算反应消耗锌的质量;
(3)根据氯化锌和硝酸银溶液反应方程式计算消耗的AgNO3的物质的量,再根据V=![]() 计算 AgNO3溶液的体积。
计算 AgNO3溶液的体积。
I.(1)1个氢气分子中含2个H原子,n(H2)=![]() =0.1mol,n(H)=0.1mol×2=0.2mol,则H原子个数为0.2NA=1.204×1023,
=0.1mol,n(H)=0.1mol×2=0.2mol,则H原子个数为0.2NA=1.204×1023,
故答案为:1.204×1023;
(2)12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=![]() n(Na+)=0.4mol×
n(Na+)=0.4mol×![]() =0.2mol,Na2X的摩尔质量为:M(Na2X)=
=0.2mol,Na2X的摩尔质量为:M(Na2X)=![]() =62g/mol,
=62g/mol,
故答案为:62g/mol;
II.(1)1L该浓盐酸中含有的氯化氢的质量为:![]() mol=12mol,该盐酸的物质的量浓度为:12mol/L,
mol=12mol,该盐酸的物质的量浓度为:12mol/L,
故答案为:12mol/L;
(2)含有的氯化氢的物质的量为12mol/L×0.01L=0.12mol,消耗锌的物质的量为0.06mol,质量m=0.06mol×65g/mol=3.9g,
故答案为:3.9g;
(3)反应后,溶液中溶质氯化锌的物质的量为0.06mol,含Cl-0.12mol,则反应消耗 AgNO3为0.12mol,AgNO3溶液体积为V=![]() =
=![]() =0.2L=200mL,
=0.2L=200mL,
故答案为:200。


科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应 CO2(g) + C(s)![]() 2CO(g) △H >0 达到平衡后,改变下列条件,分析指定物质的浓度及平衡如何变化:
2CO(g) △H >0 达到平衡后,改变下列条件,分析指定物质的浓度及平衡如何变化:
(1)增加C的量 ,平衡______________(填“向正反应方向移动”或“向逆反应方向移动”或“不移动” ;下同),c(CO)_______ (填“增大”或“减小”或“不变”;下同)
(2)减小密闭容器的体积,保持温度不变, 则平衡_____________,c(CO2)________。
(3)通入N2,保持密闭容器体积和温度不变, 则平衡___________,c(CO2)________。
(4)保持密闭容器体积不变,升高温度, 则平衡______________, c(CO)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol/L H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+
2Fe2++ O2↑+ 2H+,② H2O2 + 2Fe2+ + 2H+ ![]() 2Fe3++2H2O,
2Fe3++2H2O,
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
反应过程中能量变化如下图所示。

下列说法不正确的是
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol/( L·min)
B. Fe3+的作用是增大过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq) ![]() 2H2O(l) + O2(g)的△H > 0
2H2O(l) + O2(g)的△H > 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】14g铜金合金与足量的某浓度HNO3反应,将产生的气体用2.24L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为( )
A.9.6gB.6.4gC.12.8gD.1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体。

请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是_______________。实验室中进行该操作时,用到的玻璃仪器有烧杯、______________________。
(2)溶液A中的阴离子主要有__________________;由合金生成A溶液的离子方程式为:_______________。试剂X是________________。
(3)向溶液A中通入过量CO2气体生成固体C的离子方程式为_________________。
(4)从环境保护角度考虑,采用固体F加入足量稀硫酸里加热并鼓入空气来制备CuSO4溶液,其化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)已知:氢气的燃烧热ΔH=-285.8 kJ/mol,则氢气燃烧的热化学方程式可表示为_____。
(2)如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,此反应的热化学方程式为________________。

(3)已知:1 mol水蒸气变成液态水放热44 kJ,结合本题(1)、(2)信息,推知:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=________ kJ/mol。
2Cl2(g)+2H2O(g) ΔH=________ kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.通常情况下,甲烷和强酸、强碱、强氧化剂不起反应
B.等物质的量的甲烷与氯气发生取代反应,产物中一氯甲烷的物质的量最多
C.甲烷的氯代物都难溶于水
D.光照下甲烷与氯气发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于反应2HI(g) ![]() H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com