
【题目】按要求回答下列问题:
(1)已知:氢气的燃烧热ΔH=-285.8 kJ/mol,则氢气燃烧的热化学方程式可表示为_____。
(2)如图所示是101kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,此反应的热化学方程式为________________。

(3)已知:1 mol水蒸气变成液态水放热44 kJ,结合本题(1)、(2)信息,推知:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=________ kJ/mol。
2Cl2(g)+2H2O(g) ΔH=________ kJ/mol。
【答案】 2H2(g) + O2(g)=2H2O(l) ΔH=-571.6 kJ/mol H2(g) + Cl2(g)=2HCl(g) ΔH=-183 kJ/mol -117.6
【解析】⑴. 已知氢气的燃烧热ΔH=-285.8 kJ/mol,根据燃烧热的定义可知,2mol氢气完全燃烧生成液态水放出的热量为285.8kJ×2=571.6 kJ,则氢气燃烧的热化学方程式可表示为2H2(g) + O2(g) ![]() 2H2O(l) ΔH=-571.6 kJ/mol,故答案为:2H2(g) + O2(g)
2H2O(l) ΔH=-571.6 kJ/mol,故答案为:2H2(g) + O2(g) ![]() 2H2O(l) ΔH=-571.6 kJ/mol;
2H2O(l) ΔH=-571.6 kJ/mol;
⑵. 对应化学反应H2(g) + Cl2(g)![]() 2HCl(g),△H=反应物的键能总和-生成物的键能总和=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,则此反应的热化学方程式为:H2(g) + Cl2(g)
2HCl(g),△H=反应物的键能总和-生成物的键能总和=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,则此反应的热化学方程式为:H2(g) + Cl2(g)![]() 2HCl(g) ΔH=-183 kJ/mol,故答案为:H2(g) + Cl2(g)
2HCl(g) ΔH=-183 kJ/mol,故答案为:H2(g) + Cl2(g)![]() 2HCl(g) ΔH=-183 kJ/mol;
2HCl(g) ΔH=-183 kJ/mol;
⑶.已知:① 2H2(g) + O2(g) ![]() 2H2O(l) ΔH=-571.6 kJ/mol
2H2O(l) ΔH=-571.6 kJ/mol
② H2(g) + Cl2(g)![]() 2HCl(g) ΔH=-183 kJ/mol
2HCl(g) ΔH=-183 kJ/mol
③ H2O (g)![]() H2O(l) ΔH=-44 kJ/mol
H2O(l) ΔH=-44 kJ/mol
根据盖斯定律可知,①-②×2-③×2得4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-117.6kJ/mol,故答案为:-117.6kJ/mol。
2Cl2(g)+2H2O(g) ΔH=-117.6kJ/mol,故答案为:-117.6kJ/mol。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,11.2 L Cl 2 所含有的原子数目为NA
B. 常温常压下,18 g H2O 中含有的电子数目为2 NA
C. 足量的铁在0.1 mol Cl2 燃烧时转移的电子数目为0.3 NA
D. 2.0 L 0.5 mol·L-1 MgSO4溶液中含有的SO42-数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁和铝的混合物0.1mol溶于100mL 2 mol/L的H2SO4溶液中,然后滴加1 mol/L的NaOH溶液。在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。请回答:

(1)写出0--V1段直线发生反应的离子方程式________________________________。
(2)a点的沉淀有______________________ 。
(3)若当V1=140mL时,则金属粉末中n(Mg)=______mol,V2=__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体![]() 较稳定,呈白色,微溶于水,能溶于酸性溶液
较稳定,呈白色,微溶于水,能溶于酸性溶液![]() 广泛应用于环境杀菌、消毒等领域。
广泛应用于环境杀菌、消毒等领域。
I.过氧化钙晶体的制备工业上生产![]() 的主要流程如下:
的主要流程如下:

(1)用上述方法制取![]() 的化学方程式是 ____________________________________________________。
的化学方程式是 ____________________________________________________。
(2)沉淀时常用冰水控制温度在![]() 以下和通入过量的
以下和通入过量的![]() ,其可能原因分别是
,其可能原因分别是
①___________________________________;②__________________________________________.
II.过氧化钙晶体含量的测定
准确称取![]() 产品于锥形瓶中,加入30mL蒸馏水和
产品于锥形瓶中,加入30mL蒸馏水和![]() ,用
,用![]() 标准溶液滴定至终点
标准溶液滴定至终点![]() 重复上述操作两次。
重复上述操作两次。
③滴定终点观察到的现象为 _______________________________________________________________。
④根据表1数据,计算产品中![]() 的质量分数 ________________________。(保留四位有效数字)
的质量分数 ________________________。(保留四位有效数字)
表![]() 标准溶液滴定数据
标准溶液滴定数据

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)0.2 g H2含有________个H原子。
(2)12.4克Na2X中含有0.4molNa+,则Na2X的摩尔质量是_________。
II.如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
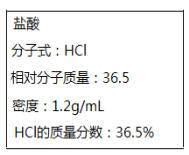
(1)求原浓盐酸的物质的量浓度c=____________。
(2)计算出m=___________。
(3)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化碳又称氧硫化碳(化学式为COS),是农药、医药和其它有机合成的重要原料。COS的合成方法之一是在无溶剂的条件下用CO与硫蒸气反应制得,该法流程简单、收效高,但含有CO2、SO2等杂质。
(1)COS的电子式为_________。
(2)已知CO2催化加氢合成乙醇的反应原理是: 2CO2(g)+6H2(g)![]() C2H5OH+3H2O(g) △H=-173.6kJ/mol
C2H5OH+3H2O(g) △H=-173.6kJ/mol
下图是不同起始投料时,CO2的平衡转化率随温度变化的关系,图中m=![]() ,为起始时的投料比,则m1、m2、m3从大到小的顺序为_______,理由是____________。
,为起始时的投料比,则m1、m2、m3从大到小的顺序为_______,理由是____________。

(3)天然气部分氧化制取的化工原料气中,常含有COS。目前COS水解是脱除COS的常见方法,即COS在催化剂作用下与水蒸气反应生成硫化氢,生成的硫化氢可用氧化锌等脱硫剂脱除。
①COS水解的化学方程式为_________________。
②常温下,实验测得脱硫(脱除硫化氢)反应过程中,每消耗4.05gZnO,放出3.83kJ热量。该脱硫反应的热化学方程式为_________________。
③近年来,电化学间接氧化法处理硫化氢的技术得到较快发展。该方法是利用Fe3+在酸性条件下与H2S反应生成硫单质,反应后的溶液再用电解的方法“再生”,实现循环利用。电解法使Fe3+“再生”的离子方程式为___________,该反应的阳极材料是______。
④常温下,HCl和CuCl2的混合溶液中,c(H+)=0.30mol/L,c(Cu2+)=0.10mol/L,往该溶液中通入H2S至饱和(H2S的近似浓度为0.10mol/L),_____(填“能”或“不能”)出现沉淀,用必要的计算过程和文字说明理由。
(已知Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-5,Ksp(CuS)=1.4×10-36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.14C和14N互为同位素
B.1H和2H是不同的核素,它们的化学性质相同
C.金刚石、石墨和C60互为同素异形体
D.CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。完成下列填空:
(1)碳原子的原子结构示意图是_____________;CO2的化学键类型_______________________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。______________________。
(3)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_____________________,证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+H2O→Na2SO4+H2SO4,该反应中,氧化产物是_____;若反应中转移了0.04mol的电子,有____g Na2S2O5参加反应。
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:
5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于锥形瓶中,用0.1000mol/L的KMnO4溶液滴定。重复上述操作2次,平均消耗KMnO4溶液21.00mL。则该样品中Na2S2O4的质量分数为________(杂质不参与反应)。(保留至0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com