
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体。

请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是_______________。实验室中进行该操作时,用到的玻璃仪器有烧杯、______________________。
(2)溶液A中的阴离子主要有__________________;由合金生成A溶液的离子方程式为:_______________。试剂X是________________。
(3)向溶液A中通入过量CO2气体生成固体C的离子方程式为_________________。
(4)从环境保护角度考虑,采用固体F加入足量稀硫酸里加热并鼓入空气来制备CuSO4溶液,其化学方程式是_______________________________。
【答案】过滤 玻璃棒、漏斗 AlO2-、OH- 2Al+2OH-+2H2O=2AlO2-+3H2↑或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 稀硫酸 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 2Cu+O2+2H2SO4 ![]() 2CuSO4+2H2O
2CuSO4+2H2O
【解析】
合金溶于过量的氢氧化钠溶液中生成偏铝酸钠,铁和铜不溶。偏铝酸钠溶液中通入过量的二氧化碳生成氢氧化铝沉淀,氢氧化铝溶解在盐酸中生成氯化铝,最终得到氯化铝晶体;铁和铜的混合物中加入稀硫酸生成硫酸亚铁,最终可以得到绿矾晶体。由于铜不溶,可以加入足量稀硫酸里加热并鼓入空气来制备CuSO4溶液,据此判断。
(1)步骤Ⅰ、Ⅱ、Ⅲ中均分离产生固体,所以需进行的实验操作是过滤。实验室中进行该操作时,用到的玻璃仪器有烧杯、玻璃棒、漏斗。
(2)溶液A中的阴离子主要有铝与氢氧化钠生成的AlO2-和剩余氢氧化钠的OH-;合金溶于过量的氢氧化钠溶液中生成偏铝酸钠和氢气,铁和铜不溶,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;由于要制备绿矾,则试剂X是能够溶解铁的稀硫酸。
(3)向溶液A中通入过量CO2气体生成固体C氢氧化铝的离子反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)从环境保护角度考虑,用固体F制备CuSO4溶液的方法不是用铜与浓硫酸反应转化为硫酸铜,而是在加热条件下铜被氧气氧化为氧化铜,再被稀硫酸溶解生成硫酸铜,反应的化学方程式为2Cu+O2+2H2SO4![]() 2CuSO4+2H2O。
2CuSO4+2H2O。


科目:高中化学 来源: 题型:
【题目】下列有关葡萄糖的说法正确的是( )。
A. 蔗糖、麦芽糖水解都只生成葡萄糖 B. 葡萄糖与果糖互为同分异构体
C. 用银氨溶液可以检验葡萄糖和麦芽糖 D. 葡萄糖、乙酸乙酯和乙酸的最简式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2) / mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列说法正确的是
A. 0~2 min内的平均速率为υ (CO)=0.6 mol/(L·min)
B. 4 min后,平衡移动的原因可能是再向容器中加入了2.0 mol的SO2
C. 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D. 若其他条件不变,起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH4Cl浓度小于0.1 mol/L时,溶液pH > 5.1现用0.1 mol/L HCl溶液来滴定10 mL 0.05 mol/L氨水,用甲基橙作指示剂,达到终点时所用盐酸的体积( )
A. = 10 mL B. = 5 mL C. > 5 mL D. < 5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)0.2 g H2含有________个H原子。
(2)12.4克Na2X中含有0.4molNa+,则Na2X的摩尔质量是_________。
II.如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
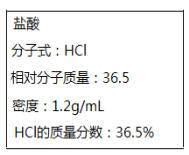
(1)求原浓盐酸的物质的量浓度c=____________。
(2)计算出m=___________。
(3)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向2.0 L恒容密闭容器中充入2.08 mol PCl5,反应PCl5(g) ![]() PCl3(g) + Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g) + Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 56 | 0. 75 | 0. 80 | 0. 80 |
回答下列问题:
(1)反应在前50 s 的平均速率v(PCl3)= _______mol/( L·s) 。
(2)T℃时,起始时向容器中充入1. 2 mol PCl5、0. 40 mol PCl3 和0. 20 mol Cl2,反应达到平衡前v(正)__________(选填“>”、“=”或“ <”)v(逆) 。
(3)T℃时,若起始时向容器中充入6. 0 mol PCl3 和6. 0 mol Cl2,达到平衡时,平衡混合气体中PCl5的体积分数为多少?(写出解题过程)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.通过灼烧时产生的气味可以鉴别蚕丝和棉纱
B.淀粉和纤维素互为同分异构体
C.人的皮肤上不慎沾染浓硝酸后变黄色是物理变化
D.蛋白质溶液中加入饱和硫酸铵溶液,会使蛋白质变性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com