
【题目】沉淀转化广泛应用于工业生产和科学实验。为了探究AgCl、Ag2S(黑色)的溶解性及转化等相关性质,做以下实验:
步 骤 | 现 象 |
Ⅰ.将NaCl溶液滴入AgNO3溶液中至恰好完全反应。 | 产生白色沉淀。 |
Ⅱ.过滤出Ⅰ中的白色沉淀置于试管中,在试管中加入过量Na2S溶液并充分振荡。 | 白色沉淀变为黑色。 |
Ⅲ.过滤出Ⅱ中的黑色沉淀置于试管中,在试管中加入过量的NaCl溶液并充分振荡后静置。 | 沉淀由黑色最后完全变为乳白色。 |
回答下列问题:
(1)Ⅰ中的白色沉淀是__________。
(2)写出Ⅱ中沉淀变黑的离子方程式__________ ,沉淀转化的主要原因是______________。
(3)滤出步骤Ⅲ中的乳白色沉淀,加入过量的浓HNO3使之充分反应,有红棕色气体生成,尚有部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀;
ⅱ.将Y与足量的KI溶液充分混合,白色沉淀最终转化为黄色沉淀。
① 由ⅰ判断,滤液X中被检出的离子是_______。
② 由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有__________和__________。
(4)为了证明实验步骤Ⅲ中的黑色沉淀只有在NaCl存在下,才能和氧气反应转化为乳白色沉淀,设计了如下对照实验并将实验结果记录在右侧的表格中。
装置 | 实验结果 |
B | 一段时间后,出现乳白色沉淀 |
C | 一段时间后,无明显变化 |
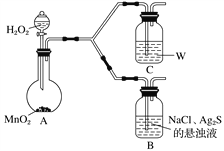
①A中,盛有MnO2的玻璃仪器名称是_________________。
②C中盛放的是物质W的悬浊液,W是________(填化学式)。
③请完成B中发生反应的反应式并配平:_____
Ag2S+ + + H2O![]() AgCl+ + NaOH
AgCl+ + NaOH
________
【答案】 AgCl 2AgCl+S2— =Ag2S+2Cl— Ag2S的溶解度小于AgCl或Ag2S更难溶 SO42— AgCl S 平底烧瓶 Ag2S 2 Ag2S+4NaCl+O2+2 H2O=4 AgCl+2S+4 NaOH
【解析】将NaCl与AgNO3溶液混合,产生白色沉淀为氯化银沉淀,向所得固液混合物中加Na2S溶液,沉淀变为黑色,滤出黑色沉淀,加入NaCl溶液,较长时间后,沉淀变为乳白色,O2将Ag2S氧化生成S时有Ag+游离出来,NaCl中大量的Cl-与游离的Ag+结合成AgCl沉淀,由于c(Ag+)减小,有利于③中反应平衡右移,B中最终出现乳白色沉淀。
(1)将NaCl与AgNO3溶液混合发生复分解反应生成氯化银白色沉淀,Ⅰ中的白色沉淀是AgCl,故答案为:AgCl;
(2)向所得固液混合物中加Na2S溶液,会生成黑色沉淀,是因为硫化银溶解度小于氯化银,出现了沉淀转化,Ⅱ中能说明沉淀变黑的离子方程式是:2AgCl(s)+S2-Ag2S(s)+2Cl-,故答案为:2AgCl(s)+S2-Ag2S(s)+2Cl-;Ag2S比AgCl溶解度更小;
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl.用浓HNO3溶解,产生红棕色气体,是浓硝酸被还原生成的二氧化氮,部分沉淀未溶解为氯化银,则被氧化的只能为S元素,故乳白色沉淀为AgCl和S的混合物;其中S被稀硝酸氧化成硫酸根离子,则在步骤Ⅴ中向X中滴加Ba(NO3)2溶液会生成BaSO4沉淀,再结合步骤Ⅲ中黑色沉淀消失可知硫化银与空气中氧气反应生成硫单质,同时生成氯化银沉淀,过滤得到滤液X和白色沉淀Y为S。
①向X中滴加Ba(NO3)2溶液,产生白色沉淀为硫酸钡,由ⅰ判断,滤液X中被检出的离子是SO42-,故答案为:SO42-;
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀为S,故答案为:AgCl;S;
(4)①A中,盛有MnO2的玻璃仪器是平底烧瓶,故答案为:平底烧瓶;
②进一步确认步骤Ⅲ中乳白色沉淀产生的原因,装置C中的试剂为NaCl溶液和Ag2S悬浊液的混合物,则装置C中应该不含氯化钠溶液,即为Ag2S悬浊液,通过对比反应现象判断生成乳白色沉淀产生的原因,故答案为:Ag2S;
③装置C中生成的白色沉淀为氯化银和S单质,反应物应该还有氧气,产物中钠离子只能以NaOH形式存在,则未知的反应物为NaOH,再根据H元素守恒可知另一种未知反应物为水,然后根据化合价升降相等配平可得反应方程式:2Ag2S+4NaCl+O2+2H2O4AgCl+2S+4NaOH,故答案为:2Ag2S+4NaCl+O2+2H2O4AgCl+2S+4NaOH。


科目:高中化学 来源: 题型:
【题目】用pH= 1的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为x和y,则x和y的关系正确的是( )
A.x> y
B.x<y
C.x= y
D.x≤y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,11.2 L四氯化碳中含有的共价键数为2NA
B. 20g T218O分子中含有的中子数为10N A
C. 0.1 mol NO与O2的混合气体中,所含原子总数为0.2 NA
D. 0.1 mol KI与0.1 mol FeCl3在溶液中反应,转移的电子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是

A. 洗气瓶中产生的沉淀是碳酸钡
B. 从Z导管出来的气体中无二氧化碳
C. 洗气瓶中产生的沉淀是碳酸钡和硫酸钡的混合物
D. Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是元素周期表的一部分,其中每个数字序号代表一种短周期元素。根据表中所列①~⑨元素,请按要求回答下列问题:
⑩ | ||||||||
① | ② | ③ | ||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素①形成的最高价氧化物的电子式为__________ ,⑤⑨两种元素形成的化合物的电子式为__________,①~⑨元素的最高价氧化物的水化物酸性最强的是__________ (填化学式)。
(2)①、⑦两种元素的最高价氧化物的熔点较高的是___________(填化学式)。
(3)由②③⑩三种元素组成的离子化合物中所含有的化学键有____________ 。
(4)①的单质与②的最高价氧化物的水化物的浓溶液反应的化学方程式为____________________。
(5)下列事实能说明③非金属性比⑧强的有___________。
a.③的单质与⑧的氢化物溶液反应,溶液变浑浊
b.③⑧形成简单离子时,得电子数目的多少
c.③与⑧两元素的简单氢化物受热分解,前者的分解温度高
d.③原子半径比⑧小
e.③与⑧两元素的简单氢化物的沸点,前者高
Ⅱ. 短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体, m 的摩尔质量为p的2倍,n是元素Y的单质, p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述的转化关系如图所示。下列说法正确的是__________ 。

A.原子半径:Y< X< Z
B.非金属性:Y> X> W
C.q与s均为酸性氧化物
D.常温下,m与q,n与s均不能共存
E.若n过量,q还可以继续燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成新型高分子M的路线如图: 
为了测定上述转化流程中有机物H的结构,做如下实验:
①将2.3g有机物H完全燃烧,生成0.1molCO2和2.7g水
②H的质谱图和核磁共振氢谱图分别为图1和图2: 
试回答下列问题:
(1)有机物H中官能团的名称 .
(2)A的分子式是C7H8 , 反应①的化学方程式: .
(3)E的分子式是C6H10O2 , E的结构简式为 .
(4)试剂b是 , 反应④的反应类型是 .
(5)反应⑥的化学方程式: .
(6)已知: 以H为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
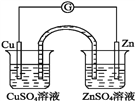
A. 铜片上发生氧化反应 B. 取出盐桥后,电流计依然发生偏转
C. 反应中,盐桥中的K+会移向CuSO4溶液 D. 反应前后铜片质量不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com