
【题目】工业废水中含有的![]() 和CrO42-会对水体产生很大的危害,这种工业废水必须净化处理。一种处理含铬废水的工艺流程如下:
和CrO42-会对水体产生很大的危害,这种工业废水必须净化处理。一种处理含铬废水的工艺流程如下:
![]()
下列说法不正确的是
A. ①中,酸化后发生反应为![]()
B. ②中,反应的氧化剂与还原剂的物质的量之比为3∶1
C. ③中,所得沉淀Cr(OH)3中含有Fe(OH)3
D. ③中调pH所用物质可以是NH3或Fe2O3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是第三周期元素,它们最高价氧化物对应的水化物溶于水,得到浓度均为0.010mol/L的溶液,其pH(25℃)与对应元素原子半径的关系如图所示。下列说法正确的是( )

A. 简单离子的半径:X>Z>W
B. 简单气态氢化物的稳定性:Z>W>Y
C. Y单质可用于制作半导体材料
D. n =2-lg2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
B.盐酸与碳酸钡反应:CO32-+2H+=CO2↑+H2O
C.硝酸银溶液中加入铜粉:Ag++Cu=Cu2++Ag↓
D.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
新型储氢材料是氢能的重要研究方向。
(1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。
①基态O原子的电子占据了___________个能层,最高能级有___________种运动状态不同的电子。
②CH4、H2O、CO2分子键角从大到小的顺序是___________。生成物H3BNH3中是否存在配位键___________(填“是”或“否”)。
(2)掺杂T基催化剂的NaAlH4是其中一种具有较好吸、放氢性能的可逆储氢材料。NaAlH4由Na+和AlH4-构成,与AlH4-互为等电子体的分子有____(任写一个),Al原子的杂化轨道类型是____。Na、Al、H元素的电负性由大到小的顺序为_____。
(3)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为___________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg/cm3。设NA为阿伏加徳罗常数的值,则该晶胞的体积是___________cm3(用含M、d、NA的代数式表示)。
③已知晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较温定,晶胞参数分别为apm、apm、cpm。标准状况下氢气的密度为Mg/cm3;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________。(用相关字母表示已知储氢能力=![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是

A. X电极连接电源负极
B. N为阳离子交换膜
C. Y电极反应式为 O2+2H2O+4e-=4OH-
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质本身的是( )
①CuSO4;②KHCO3;③FeSO4;④NH4Cl;⑤MgSO4;⑥AlCl3 ;
A. ①③ B. ①⑤ C. ①③⑤ D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六水合高氯酸铜[Cu(ClO4)2·6H2O]是一种易溶于水的蓝色晶体,常用作助燃剂。以食盐等为原料制备高氯酸铜晶体的一种工艺流程如下:
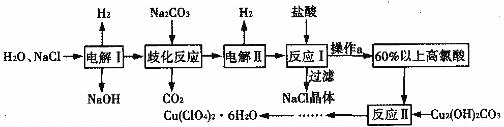
回答下列问题:
(1)Cu2(OH)2CO3在物质类别上属于__________(填序号)。
A.碱 B.盐 C.碱性氧化物
(2)发生“电解I”时所用的是__________(填“阳离子”或“阴离子”)交换膜。
(3)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。该反应的化学方程式为___________________。
(4)“电解II”的阳极产物为____________(填离子符号)。
(5)操作a的名称是______,该流程中可循环利用的物质是____________(填化学式)。
(6)“反应II”的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到目的是
A. 用PH试纸测定次氯酸溶液的pH
B. 将FeCl3溶液加热蒸干并灼烧获得Fe2O3固体
C. 向明矾溶液中加入一定量NaOH,制备Al(OH)3胶体
D. 室温下,测得pH=5的NaHSO4溶液与pH=9的NaHCO3溶液中水的电离程度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5mol·L-1。向20mL浓度均为0.1mol·L-1 NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的电导率与加入CH3COOH溶液的体积(V)关系如图所示。下列说法错误的是

A. M点:c(Na+)>c(CH3COO-)>c(NH3·H2O)>c(NH4+)
B. 溶液呈中性的点处于N、P之间
C. 已知1g3≈0.5,P点的pH=5
D. P点:3[c(CH3 COO-)+ c(CH3COOH)]=2[ c(Na+)+c(NH4+)+c(NH3·H2O)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com