
【题目】拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如下:

下列对该化合叙述不正确的是 ( )
A.属芳香烃;B.属烃的衍生物
C.在酸性条件下可水解;D.在一定条件下可发生加成反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 硫酸 |
pH | 11 | 11 | 3 | 3 |
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定人体血液中Ca2+的含量,设计了如下方案:
![]()
有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4 K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗了0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为
A.0.001mol·L-1B.0.0025mol·L-1 C.0.0003mol·L-1D.0.0035mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某容积恒定的密闭容器中充入1 mol N2、3 mol H2,经充分反应后达到如下平衡:N2(g)+3H2(g)![]() 2NH3(g),下列有关说法中正确的是( )
2NH3(g),下列有关说法中正确的是( )
A. 达平衡后再加入一定量的N2,体系内各物质含量不变
B. N2、H2、NH3的浓度一定相等
C. 反应没有达到平衡时,NH3会不断地分解,达到平衡时则不会再分解
D. 平衡时,N2、H2物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知维生素A的结构简式可写为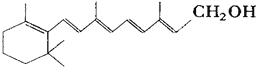 ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述不正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述不正确的是( )
A.维生素A的分子式为C20H30O
B.维生素A是一种易溶于水的醇
C.维生素A分子中有异戊二烯的碳链结构
D.1mol维生素A在催化剂作用下最多可与5molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的是离子组是( )
A.K+、Na+、![]() 、
、![]() B.Na+、
B.Na+、![]() 、Mg2+、ClO
、Mg2+、ClO
C.H+、Mg2+、![]() 、
、![]() D.Ag+、K+、
D.Ag+、K+、![]() 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知热化学方程式C2H2(g)+ ![]() O2(g)=2CO2(g)+H2O(g); △H=-1256 kJ·mol-1,下列说法正确的是
O2(g)=2CO2(g)+H2O(g); △H=-1256 kJ·mol-1,下列说法正确的是
A. 乙炔的燃烧热为1256 kJ·mol-1
B. 若生成2mol水蒸气,则放出的热量为2512 kJ·mol-1
C. 若转移10mol电子,则消耗2.5molO2
D. 若形成4mol碳氧共用电子对,则放出的热量为2512kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com