
【选修2—化学与技术】(12分)水处理技术在生产、生活中应用广泛。
(1)工业上常用绿矾做混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理的水pH调到9左右,再加入绿矾。请解释这一做法的原因:_________。(用必要的离子方程式和文字描述)。
(2)根据水中Ca2+,Mg2+的多少,把天然水分为硬水和软水,硬水必须经过软化才能使用。
①硬水软化的方法通常有___________、__________和离子交换法。离子交换树脂使用了一段时间后,逐渐由NaR型变为CaR2(或MgR2)型,而失去交换能力。把CaR2(或MgR2)型树酯置于______________中浸泡一段时间,便可再生。
②当洗涤用水硬度较大时,洗衣粉与肥皂相比,___________洗涤效果较好,原因是______________。
(3)最近我国某地苯胺大量泄漏于生活饮用水的河道中,当地采取的应急措施之一是向河水中撒入大量的活性炭,活性炭的作用是___________________。
(4)若生活污水中含大量氮化合物,通常用生物膜脱氮工艺进行处理。首先在消化细菌作用下将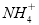 氧化为
氧化为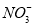 :_____
:_____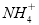 +______O2=______
+______O2=______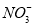 +_____H++______H2O。然后加入甲醇与
+_____H++______H2O。然后加入甲醇与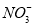 生成N2:______
生成N2:______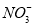 +______CH3OH=_______N2+______CO2+_________H2O+_______OH-(试配平以上两个离子方程式)。
+______CH3OH=_______N2+______CO2+_________H2O+_______OH-(试配平以上两个离子方程式)。
(12分)
(1)4Fe2+ + O2 + 2H2O + 8OH- = 4Fe(OH)3(胶体)(2分), Fe2+在碱性条件下,易被氧化成Fe3+,进而水解生成Fe(OH)3(胶体),起到较好的混凝作用。(1分)
(2)①加热法;药剂法;5%~8%的食盐水(各1分);②洗衣粉,肥皂易与Ca2+、Mg2+生成沉淀(1分)。 (3)吸附泄漏在河水中的有机物(1分)。
(4)1、2、1、2、1; 6、5、3、5、7、6(各2分)
【解析】
试题分析:(1)当pH为9时,加入绿矾,亚铁离子被氧化成铁离子,水解生成氢氧化铁胶体,有吸附性,起到较好的混凝作用。(2)①硬水软化常用的方法有加热法;药剂法等;离子交换树脂置于5%~8%的食盐水浸泡,钠离子和镁离子和钙离子交换,使离子交换树脂再生;②因为肥皂易与Ca2+、Mg2+生成沉淀,所以洗衣粉的效果更好;(3)活性炭可以吸附泄漏在河水中的有机物。(4)根据电子守恒和电荷守恒配平,因为每个氧气分子得到4个电子,每个铵根离子失去8个电子,所以二者比例为1:2,所以系数为:1、2、1、2、1; 因为硝酸根中氮元素降低5价,甲醇中碳元素化合价升高6价,所以二者比例为6:5,系数为: 6、5、3、5、7、6。
考点:水处理技术
考点分析: 考点1:化学与技术 试题属性

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
化学已渗透到人类生活的各个方面。下列说法正确的是
A.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
B.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
C.垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能
D.为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:填空题
(1 5分)X、Y为短周期主族元素,X的主族序数是周期序数的两倍,Y的原子序数比X大l.
I.若X.Y是组成蛋白质的基础元素。
(1)X和Y的气态氢化物中热稳定性较强的是 (填写化学式)。
(2)蛋白质和葡萄糖都是人体需要的有机物,检测葡萄糖存在的实验操作与现象是 。
(3)已知298K时,X和XO的标准燃烧热分别为 该温度下X转化为XO的热化学方程式为 。
该温度下X转化为XO的热化学方程式为 。
Ⅱ.若火山口附近常存在黄色的X单质。
(4)X2—的结构示意图为 。
(5)工业上常用含X元素的矿石制取H2XO4,某工厂利用100吨含X 40%的矿石为原料,制得98%H2XO4溶液100吨,则H2XO4的产率为 。
(6)工业中常用Y2与石灰浆反应制取漂白粉,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
解释下列过程的方程式正确的是
A.氯化钠溶于水发生电离,电离方程式为:NaCl Na+ + Cl
Na+ + Cl
B.用过量氨水吸收烟道气中的SO2:SO2+2NH3H2O===SO32+2NH4++H2O
C.工业冶炼金属铝:AlCl3(熔融) Al + Cl2↑
Al + Cl2↑
D.向物质的量之比为1:1的NaOH和Na2CO3混合物中加入过量稀盐酸:OH+CO32+2H+===HCO3+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列分离方法中,和物质的溶解度无关的是
A.萃取 B.盐析 C.重结晶 D.蒸馏
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:选择题
某溶液中含有 、Mg2+、Fe2+、Al3+、
、Mg2+、Fe2+、Al3+、 、
、 六种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,充分反应后溶液中大量减少的离子有
六种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,充分反应后溶液中大量减少的离子有
A. 、Fe2+、
、Fe2+、 B.
B. 、
、 、
、
C.Mg2+、Fe2+、 D.Fe2+、Al3+、
D.Fe2+、Al3+、
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:选择题
双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断正确的是

A.a气体为氢气,b气体为氧气
B.A溶液为氢氧化钠,B溶液为硫酸
C.c隔膜为阳离子交换膜、d隔膜为阴离子交换膜
D.该电解反应的总方程式可以表示为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:选择题
依据下图判断,下列说法正确的是

A.2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低
B.氢气的燃烧热为△H = -241.8 kJ·mol-1
C.液态水分解的热化学方程式为:2H2O(l) == 2H2(g) + O2(g) △H = +571.6 kJ·mol-1
D.H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:填空题
(8分)五种短周期元素 A、B、C、D、E 的原子序数依次增大。A 的最高价氧化物与 B 的氢化物在水中反应得到的生成物既可与酸反应又可与碱反应。C、D 为金属元素,且 D 原子最外层电子数等于其 K 层电子数,而 C 的阳离子半径大于 D 的阳离子。若往 E 单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色。请回答下列问题:
(1)C在元素周期表中的位置是 E的氢化物的电子式为
(2)B和 E 的氢化物相互反应得到的产物中含有化学键的类型是
(3)A、E 元素形成的化合物的结构式是
(4)D 单质能与A的最高价氧化物反应,写出反应的方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com