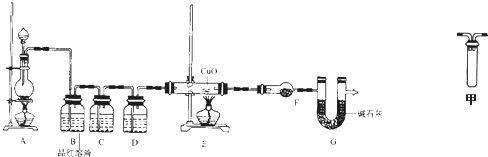
高铁酸钾是一种新型高效多功能水处理剂.工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化Fe(NO
3)
3制得Na
2FeO
4:3NaClO+2Fe(NO
3)
3+10NaOH=2Na
2FeO
4↓+3NaCl+6NaNO
3+5H
2O
②Na
2FeO
4与KOH反应生成K
2FeO
4:Na
2FeO
4+2KOH=K
2FeO
4+2NaOH
主要的生产流程如下:
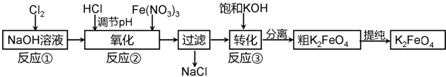
(1)加入盐酸调节溶液pH时需用pH试纸粗略测试pH以控制加入盐酸的量.实验室用pH试纸测定溶液pH的操作是
.
(2)流程图中“转化”(反应③)是在某低温下进行的,说明此温度下K
sp(K
2FeO
4)
K
sp(Na
2FeO
4)(填“>”或“<”或“=”).
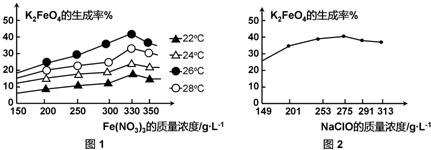
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.
图1为不同的温度下,Fe(NO
3)
3不同质量浓度对K
2FeO
4生成率的影响;
图2为一定温度下,Fe(NO
3)
3质量浓度最佳时,NaClO浓度对K
2FeO
4生成率的影响.
工业生产中最佳温度为
℃,此时Fe(NO
3)
3与NaClO两种溶液最佳质量浓度之比为
.
(4)K
2FeO
4在水溶液中易“水解”:4FeO
42-+10H
2O?4Fe(OH)
3+8OH
-+3O
2.在“提纯”K
2FeO
4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
溶液(填序号).
A.H
2O B.CH
3COONa、异丙醇 C.NH
4Cl、异丙醇 D.Fe(NO
3)
3、异丙醇
(5)K
2FeO
4处理水时,不仅能消毒杀菌,还能除去水体中的H
2S、NH
3等,生成的Fe(OH)
3胶体还能吸附水中的悬浮杂质.根据污染物的实际情况向水中加入适量的K
2FeO
4将污染物转化为无污染的物质,试写出K
2FeO
4处理含有NH
3污水时与NH
3反应的离子方程式
.