


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
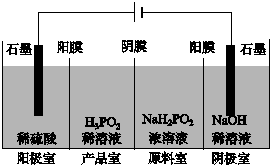 次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加石蕊试液显红色的溶液:Fe3+、NH4+、CO32-、I- |
| B、pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Cl-、Ba2+ |
| D、所含溶质为Na2CO3的溶液:K+、Na+、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2+H2SO4=SO2↑+O2↑+2H2O |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、Cl2+SO2+2H2O=H2SO4+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
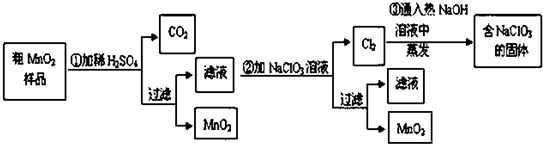
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、①④ | C、②③ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
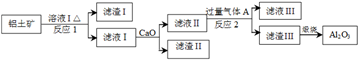
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com