
【题目】β—月桂烯的结构如图所示,下列说法正确的是
![]()
A. 与乙烯互为同系物
B. 与其互为同分异构体且苯环上只有一个侧链的共有4种
C. 化学式为C10H16
D. 一分子该物质与一分子溴发生加成最多有3种产物
科目:高中化学 来源: 题型:
【题目】实验装置如下图所示。先关闭K,使A中的反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。请回答下列有关问题:
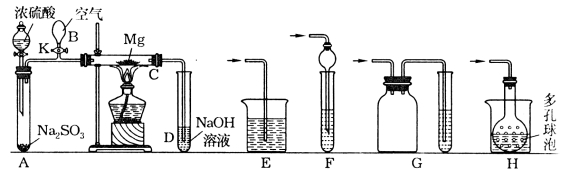
(1)C中全部产物有 、 、 。
(2)本实验先使A中反应进行,再加热C装置,其目的是 。
(3)停止实验时,先打开K,再停止滴加浓硫酸,熄灭酒精灯,橡胶气胆B在实验中的作用是 。
(4)若无装置B、K,使用普通导管,本实验的尾气吸收装置可以选用上图中装置 (填写序号,多选扣分)。
(5)C中的Mg应放在不锈钢垫片上而不能直接接触管壁的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产含氯有机物时会产生HCl,利用反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)可实现氯的循环利用。完成下列填空:
2Cl2(g)+2H2O(g)可实现氯的循环利用。完成下列填空:
(1)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是_________(选填序号)。
a.2ν(HCl)正=ν(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.K=![]()
(2)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似。下列有关说法不正确的是___(选填序号)。
a.S2C12分子中有4对共用电子对 b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为-1价 d.S2C12分子中各原子均为8电子稳定结构。
(3)已知X2(g)+H2(g)![]() 2HX(g)+Q(X2表示Cl2、Br2)如图表示上述反应的平衡常数K与温度T的关系。
2HX(g)+Q(X2表示Cl2、Br2)如图表示上述反应的平衡常数K与温度T的关系。
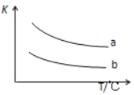
①Q表示X2(g)与H2(g)反应的反应热,Q____0(填“>”、“<”或“=”)。
②写出曲线b表示的平衡常数K的表达式,K=_________________(表达式中写物质的化学式)。
(4)向新制的氯水中加入少量下列物质,能增强溶液漂白能力的是(_______)
A.氯化钙 B.碳酸钙粉末 C.二氧化硫溶液 D.稀硫酸
(5)若向氯化银沉淀中逐渐滴加HBr,会看到白色沉淀逐渐变为淡黄色沉淀现象,请用溶解平衡原理解释此现象____。
(6)已知BBr3与BI3的空间构型是平面三角形结构,则它们是____分子(填极性或非极性),且BBr3的沸点低于BI3,原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3CuO+2NH3![]() 3Cu+N2+3H2O。下列判断正确的是
3Cu+N2+3H2O。下列判断正确的是
A.N元素的化合价降低B.NH3被还原
C.消耗0.3 mol CuO转移0.6 NA个电子D.CuO是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础。下列与“物质的量”相关的计算正确的( )
A.现有CO、CO2、O3三种气体,它们分别都含有1molO,则三种气体的物质的量之比为 3∶2∶1
B.5.6g CO 和22.4L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为 35.5m/n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
Ⅰ.利用反应:6NO2+8NH3![]() 7N2+12H2O处理
7N2+12H2O处理
Ⅱ.一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g)-Q (Q>0)
SO3(g)+NO(g)-Q (Q>0)
Ⅲ.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
(1)硫离子最外层电子的电子排布式为_____,氨气分子的电子式为______,氨气分子属于______分子(填“极性”或者“非极性”)。
(2)C、O、S这三种元素中属于同周期元素的非金属性由强到弱的顺序为______,能证明其递变规律的事实是_______。
a.最高价氧化物对应水化物的酸性 b.气态氢化物的沸点
c.单质与氢气反应的难易程度 d.其两两组合形成的化合物中元素的化合价
(3)对于Ⅰ中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均速率v(NO2)=_______。
(4)对于Ⅱ中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变 b.NO2浓度保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
(5)请写出Ⅱ中反应的平衡常数表达式K=_______,如果Ⅱ中反应的平衡常数K值变大,该反应______。
a.一定向正反应方向移动 b.平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动 d.平衡移动时,逆反应速率先增大后减小
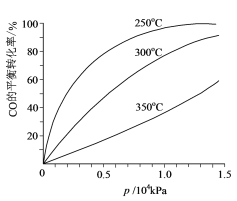
(6)对于Ⅲ中的反应,CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,简述选择此压强的理由:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是_______(填元素符号);①的核外电子排布式______;⑤的最外层核外电子的轨道表示式______ ;③和⑥两元素形成化合物的电子式为________。
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是________(填该物质化学式)。
(3)比较④、⑤两种元素的简单离子半径:___>___(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为____________________________。
(4)列举两个事实来证明元素①比元素⑤的非金属性强______;___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院深圳先进技术研究院研发出一种新型铝—石墨烯双离子电池(AGDIB电池),该电池以溶有六氟磷酸锂(LiPF6)的碳酸酯类溶剂为电解液,放电时合金AlLi发生去合金化反应,阴离子(PF-)从石墨烯Cx中脱嵌,进入电解质溶液。放电时其工作原理如图所示,下列说法错误的是( )
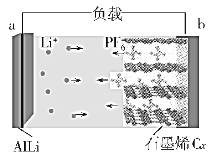
A.该电池不能用水作为电解质溶液
B.放电时,a电极的电极反应式为AlLi-e-=Li++Al
C.充电时,b电极的电极反应式为PF6--e-+Cx=CxPF6
D.废旧AGDIB电池进行“放电处理”时,若转移1mole-,则可回收7gLi
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com