
【题目】用Cl2生产含氯有机物时会产生HCl,利用反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)可实现氯的循环利用。完成下列填空:
2Cl2(g)+2H2O(g)可实现氯的循环利用。完成下列填空:
(1)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是_________(选填序号)。
a.2ν(HCl)正=ν(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.K=![]()
(2)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似。下列有关说法不正确的是___(选填序号)。
a.S2C12分子中有4对共用电子对 b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为-1价 d.S2C12分子中各原子均为8电子稳定结构。
(3)已知X2(g)+H2(g)![]() 2HX(g)+Q(X2表示Cl2、Br2)如图表示上述反应的平衡常数K与温度T的关系。
2HX(g)+Q(X2表示Cl2、Br2)如图表示上述反应的平衡常数K与温度T的关系。
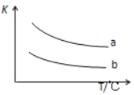
①Q表示X2(g)与H2(g)反应的反应热,Q____0(填“>”、“<”或“=”)。
②写出曲线b表示的平衡常数K的表达式,K=_________________(表达式中写物质的化学式)。
(4)向新制的氯水中加入少量下列物质,能增强溶液漂白能力的是(_______)
A.氯化钙 B.碳酸钙粉末 C.二氧化硫溶液 D.稀硫酸
(5)若向氯化银沉淀中逐渐滴加HBr,会看到白色沉淀逐渐变为淡黄色沉淀现象,请用溶解平衡原理解释此现象____。
(6)已知BBr3与BI3的空间构型是平面三角形结构,则它们是____分子(填极性或非极性),且BBr3的沸点低于BI3,原因是____________。
【答案】b ab > ![]() B 氯化银悬浊液中存在AgCl(s)
B 氯化银悬浊液中存在AgCl(s)![]() Ag+(aq)+Cl—(aq),AgBr的溶解平衡常数小于AgCl,因此滴入HBr的过程中,Ag++Br—=AgBr↓,Ag+浓度降低,AgCl溶解平衡正向移动,AgCl不断溶解,最终生成了AgBr淡黄色沉淀 非极性 两者同属于分子晶体,且结构相似,BBr3相对分子质量小于BI3,因此BI3的分子间作用力更大,沸点更高
Ag+(aq)+Cl—(aq),AgBr的溶解平衡常数小于AgCl,因此滴入HBr的过程中,Ag++Br—=AgBr↓,Ag+浓度降低,AgCl溶解平衡正向移动,AgCl不断溶解,最终生成了AgBr淡黄色沉淀 非极性 两者同属于分子晶体,且结构相似,BBr3相对分子质量小于BI3,因此BI3的分子间作用力更大,沸点更高
【解析】
(1)a、反应速率之比等于化学方程式计量数之比为正反应速率之比,ν(HCl)正=2ν(Cl2)逆,说明氯气的正逆反应速率相同,反应达到平衡状态,但2ν(HCl)正=ν(Cl2)逆不能说明正逆反应速率相同,故a错误;b、反应前后气体物质的量变化,体系压强不再改变,说明反应达到平衡状态,故b正确;c、反应前后气体质量和体积不变,混合气体密度始终不变,不能说明反应达到平衡状态,故c错误;d、温度一定时,![]() =K说明反应达到平衡状态,但温度不知不能说明反应达到平衡状态,故d错误;故答案为:b;
=K说明反应达到平衡状态,但温度不知不能说明反应达到平衡状态,故d错误;故答案为:b;
(2)S2Cl2的分子结构与H2O2相似,所以S2Cl2的分子结构与H2O2相似,结构式为Cl-S-S-Cl,所以分子中有3对共用电子对,S2Cl2分子中有硫硫非极性,S2Cl2分子中,S为+1价,Cl为-1,S2C12分子中各原子均为8电子稳定结构,故选ab。
(3)①由图象可知,升高温度平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应,Q>0;
②同一温度时,a曲线的K值最大,说明卤素单质与氢气化合的能力最强,Cl2、Br2中Cl2的氧化性最强,所以最易与氢气化合的是氯气,所以b曲线表示Br2与H2反应时K与t的关系。平衡常数等于生成物与反应物的浓度幂之积,K=![]() ;
;
(4)在氯水中存在反应Cl2+H2OH++Cl-+HClO,若消耗氢离子使反应向右进行,使溶液中次氯酸浓度增大,则溶液漂白性会增强。
A.加入氯化钙溶液不发生反应,溶液对氯水起到稀释作用,平衡正向进行但次氯酸浓度减小,漂白性减弱,故A错误;
B.由于酸性HCl>H2CO3>HClO,向溶液中加入碳酸钙粉末反应反应2HCl+CaCO3=CaCl2+CO2↑+H2O,使化学平衡正向进行,导致次氯酸浓度增大,溶液漂白性增强,故B正确;
C.加入二氧化硫的水溶液,二氧化硫有还原性,能被氯气氧化,平衡逆向进行,次氯酸浓度减小,漂白性减弱,故C错误;
D.加入稀硫酸使溶液中氢离子浓度增大平衡逆向进行,次氯酸浓度减小,溶液漂白性减弱,故D错误;
故选:B。
(5)若向氯化银沉淀中逐渐滴加HBr,会看到白色沉淀逐渐变为淡黄色沉淀现象,原因是:氯化银悬浊液中存在AgCl(s)Ag+(aq)+Cl-(aq),AgBr的溶解平衡常数小于AgCl,因此滴入HBr的过程中,Ag++Br-→AgBr↓,Ag+浓度降低,AgCl溶解平衡正向移动,AgCl不断溶解,最终生成了AgBr淡黄色沉淀;
(6)已知BBr3与BI3的空间构型是平面三角形结构,分子为非极性分子,两者同属于分子晶体,且结构相似,BBr3相对分子质量小于BI3,因此BI3的分子间作用力更大,沸点更高。


科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
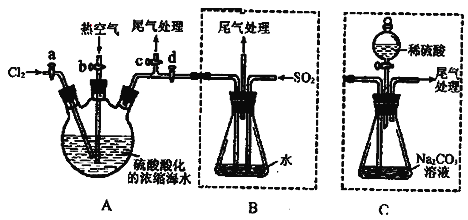
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入氯气至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)工业上采用电解饱和食盐水的方法来制备氯气,该反应的化学方程式为______________________________________________________________________;
(2)步骤②中鼓入热空气的作用为___________________________________;此实验中尾气可用_____(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
(3)步骤③中发生的主要反应的离子方程式为______________________________。
(4)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBr、NaBrO3等,该反应的化学方程式为___________________________________。
(5)与B装置相比,采用C装置的优点为________________,__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】惕格酸(C5H8O2,分子中有两个甲基)可用于制备香精,由烃A生成惕格酸的反应如下:

(1)写出结构简式。A:_________________C:________________________。
(2)写出反应类型。反应Ⅰ:______________反应、反应Ⅴ:____________反应。
(3)写出反应Ⅱ化学反应方程式:______________________________________。
(4)如何检验 中的溴元素?____________________________。
中的溴元素?____________________________。
(5)写出符合下列条件的惕格酸的同分异构体的结构简式:________________________。条件:与惕格酸含相同官能团,且也有两个甲基。
(6)近年来,乳酸![]() 成为人们的研究热点之一。试写出以丙烯(CH2=CH—CH3)为原料,合成乳酸的路线流程图(无机试剂任选)。___________(合成路线常用的表示方式为:甲
成为人们的研究热点之一。试写出以丙烯(CH2=CH—CH3)为原料,合成乳酸的路线流程图(无机试剂任选)。___________(合成路线常用的表示方式为:甲![]() 乙…
乙…![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
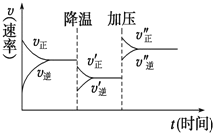
A.正反应是放热反应B.A、B一定都是气体
C.D一定不是气体D.C可能是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,按要求用化学式或化学用语填空,用序号填写不得分。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为_____________;
(2)地壳中含量最多的非金属元素是_____________;
(3)与水反应最剧烈的金属单质是_____________;
(4)某元素三价阳离子的核外有10个电子,该元素是_____________;
(5)气态氢化物最稳定的化合物是_____________;
(6)①的最高价氧化物的电子式为_____________;
(7)用电子式表示④和⑨形成化合物的过程_____________。
(8)最高价氧化物对应的水化物碱性最强的化合物是_____________;元素的最高价氧化物对应的水化物中具有两性的化合物是_____________;两者反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 28g乙烯、丙烯的混合气体中所含原子数为6NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L氯仿(CHCl3)所含分子数为0.5 NA
D. 78g苯中含有C—C键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β—月桂烯的结构如图所示,下列说法正确的是
![]()
A. 与乙烯互为同系物
B. 与其互为同分异构体且苯环上只有一个侧链的共有4种
C. 化学式为C10H16
D. 一分子该物质与一分子溴发生加成最多有3种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是 ________。
(2)根据上述反应,鉴别 NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:
____Al+____NaNO3+____NaOH=____NaAlO2+____ N2↑+___H2O
(4)若反应过程中转移5 mol 电子,则生成标准状况下N2的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):

(1)乙醇能与乙酸反应生成有果香味的物质,其名称为__________,该反应类型是____________
(2)反应⑥的化学方程式是______________实验现象是__________________
(3)反应③用KOH的乙醇溶液处理二氯乙烷制氯乙烯的方程式为:____________
(4)苯乙烯中所含官能团的名称_____________
(5)苯乙烯合成聚苯乙烯的化学方程式是_____________________
(6)以乙醇和苯乙烯为原料合成有机物![]() ,写出合成路线图_________________。
,写出合成路线图_________________。
(合成路线常用的表示方法为:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com