
1.《有机化学基础》
已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:

现有分子式为C9H8O2Br2的物质M,有机物C的相对分子质量为60,在一定条件下可发生下述一系列反应:

请回答下列问题:
(1)G→H的反应类型是_______________。
(2)M的结构简式为_______________;C的结构简式为_______________。
(3)写出下列反应的化学方程式:
①A→B的化学方程式:________________________________________________________;
②H→I的化学方程式:_________________________________________________________。
2.《物质结构与性质》Ⅰ.图表法、图像法是常用的科学研究方法。


图A 图B
(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第_____族。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第_____族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是_____(填“a”或“b”)。
Ⅱ.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(3)Ti元素的基态原子的价电子层排布式为____________。
(4)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如下图,它的化学式是__________;晶体内与每个“Ti”紧邻的氧原子数为_________个。

(5)已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。则绿色晶体配合物的化学式为_______________。
。则绿色晶体配合物的化学式为_______________。
1.(1)加成反应(还原反应)
(2)![]() CH3COOH
CH3COOH
(3)①CH3CHO+2Ag(NH3)2OH![]() 2Ag↓+CH3COONH4+3NH3+H2O
2Ag↓+CH3COONH4+3NH3+H2O

解析:C的相对分子质量为60,又B可以生成C,所以C为CH3COOH,A为CH3CHO;H转化为I时,产物只有一种结构,说明D中苯环上的取代基处于对位,D的结构简式为![]() ,E为
,E为![]() ,则M的结构简式为
,则M的结构简式为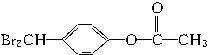 。
。
2.(1)ⅢA (2)ⅣA b (3)3d24s2 (4)BaTiO3 6 (5)[TiCl(H2O)5]Cl2·H2O
解析:Ⅰ.(2)由于NH3、H2O、HF中均存在氢键而使沸点升高,所以折线c只能表示第ⅣA族元素氢化物的沸点变化规律。由于氢键的存在,导致第ⅤA族、第ⅥA族、第ⅦA族的氢化物中都是第二周期元素的氢化物沸点最高,所以b正确。
Ⅱ.(3)Ti的基态原子的价电子排布式为3d24s2。
(4)晶胞中含Ti原子8×![]() =1个,含O原子12×
=1个,含O原子12×![]() =3个,含Ba原子1个,所以偏钛酸钡的化学式为BaTiO3。
=3个,含Ba原子1个,所以偏钛酸钡的化学式为BaTiO3。
(5)绿色晶体与AgNO3反应生成的AgCl是紫色晶体的![]() ,说明绿色晶体中有1个Cl-作配体,其化学式为[TiCl(H2O)5]Cl2·H2O。
,说明绿色晶体中有1个Cl-作配体,其化学式为[TiCl(H2O)5]Cl2·H2O。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:阅读理解
(A)有机化学反应因反应条件不同,可生成不同的有机产品。例如:

苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。

请根据上述路线,回答下列问题:
(1)A的结构简式可能为________________________。
(2)反应③⑤的反应类型分别为________________________、_____________________。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):_______________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是____________________________________________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色;②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):___________________________________。
28.(B)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
(1)甲、乙两分子中含有非极性共价键的物质的电子式是________________________,C元素在周期表中的位置是___________________________。
(2)C和D的离子中,半径较小的是_____________(填离子符号)。
(3)将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是___________________________________________________________________。
(4)C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用![]() 表示)位于正方体的棱的中点和正方体内部;阴离子
表示)位于正方体的棱的中点和正方体内部;阴离子![]() (用
(用![]() 表示)位于该正方体的顶点和面心。该化合物的化学式是________________。
表示)位于该正方体的顶点和面心。该化合物的化学式是________________。

(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是( )
A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ-Fe晶胞边长为a cm,α-Fe晶胞边长为b cm,则两种晶体密度比为2b3∶a3
D.将铁加热到1

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
《有机化学基础》模块试题
1.有机黏合剂的黏合过程是液态的小分子黏合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分为α氰基丙烯酸乙酯( ),请写出“502胶”发生黏合作用的化学方程式:_____________________________;反应类型是_____________。
),请写出“502胶”发生黏合作用的化学方程式:_____________________________;反应类型是_____________。
(2)厌氧胶( )也是一种黏合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种黏合剂,该物质的名称是_____________;请写出这一制取过程的化学方程式_________________。
)也是一种黏合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种黏合剂,该物质的名称是_____________;请写出这一制取过程的化学方程式_________________。
(3)白乳胶是常用的黏合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),它有多种同分异构体,如 、
、 、
、 。已知含有
。已知含有![]() 结构的物质不能稳定存在。请另外写出3种含—CH=CH—结构的链状同分异构体的结构简式:______________、______________、______________。
结构的物质不能稳定存在。请另外写出3种含—CH=CH—结构的链状同分异构体的结构简式:______________、______________、______________。
(4)已知醇和醛可以发生反应:2CH3OH+HCHO![]() CH3OCH2OCH3+H2O,聚乙烯醇可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力黏合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:________________。
CH3OCH2OCH3+H2O,聚乙烯醇可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力黏合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:________________。
《物质结构与性质》模块试题2.如下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

(1)请写出上图中d单质对应元素原子基态时的电子排布式_____________。
(2)单质a、f、b对应的元素以原子个数比1∶1∶1形成的分子中含_____________个σ键,_____________个π键。
(3)a与b的元素形成的10电子中性分子X的空间构型为_____________;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为________
_______,其中X与d的高价离子之间以_____________键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为:![]() ,该含氧酸的分子式为_____________,请简要说明该物质易溶于水的原因__________________________。
,该含氧酸的分子式为_____________,请简要说明该物质易溶于水的原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
选做题
从以下两道题中任选一道做。
1.光催化制氢是化学研究的热点之一。科学家利用含有吡啶环(吡啶的结构式为![]() ,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

(1)化合物Ⅱ的分子式为________________________________________。
(2)化合物Ⅰ合成方法如下(反应条件略,除化合物Ⅲ的结构未标明外,反应式已配平):
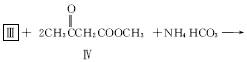
![]()
化合物Ⅲ的名称是_______________________。
(3)用化合物Ⅴ(结构式见下图)代替Ⅲ作原料,也能进行类似的上述反应,所得有机产物的结构式为____________________。

(4)下列说法正确的是________________(填字母)。
A.化合物Ⅴ的名称是间羟基苯甲醛,或2羟基苯甲醛
B.化合物Ⅰ具有还原性;Ⅱ具有氧化性,但能被酸性高锰酸钾溶液氧化
C.化合物Ⅰ、Ⅱ、Ⅳ都可发生水解反应
D.化合物Ⅴ遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
(5)吡啶甲酸酯可作为金属离子的萃取剂。2吡啶甲酸正丁酯(Ⅵ)的结构式见下图,其合成原料2吡啶甲酸的结构式为__________________;Ⅵ的同分异构体中,吡啶环上只有一个氢原子被取代的吡啶甲酸酯类同分异构体有____________________种。

Ⅵ
2.铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为_____________________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列说法正确的是_________________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_____________________。
(5)Cu2O的熔点比Cu2S的______________(填“高”或“低”),请解释原因____________________________。
@@1. (1)C11H13NO4 (2)甲醛
(3)
(4)BC
(5)![]() 12
12
查看答案和解析>>
科目:高中化学 来源:2010年河南省郑州四中高三上学期第一次调研考试化学试题 题型:填空题
(选做题)(物质结构与性质)(8分)已知A、B、C、D、E、F都是短周期的元素,它们的原子序数依次递增。A原子的电子层数与它的核外电子总数相同,而B原子的最外层电子数是次外层的2倍,C的氢化物可使湿润的红色石蕊试纸变蓝,B和D可以形成两种气态化合物,E原子核外电子总数比B的2倍少1,F在本周期元素中原子半径最小。则:
(1)A、B、C、D、E、F的名称分别是 。
(2)在A至F中任选元素,写出一种含极性键的非极性分子的分子式 ,写出一种含非极性键的离子化合物的电子式 。
(3)由B和D组成,且B和D的质量比为3∶8的化合物的结构式是 ,
该化合物分子中B原子的杂化方式为
(4)E和F形成的化合物为 晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com