
硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备
FeSO4·7H2O晶体:
① 将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2至3遍;
② 向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50-80℃之间至铁屑耗尽;
③ 趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④ 待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸将晶体吸干;
⑤ 将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
⑴ 实验步骤①的目的是____________________,加热的作用是__________________。
⑵ 实验步骤②明显不合理,理由是_______________________________。
⑶ 实验步骤④中用少量冰水洗涤晶体,其目的是______________;______________。
⑷ 经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O、和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27 | ||
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。

⑸ 若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
【答案】
⑴ 除油污 升高温度,溶液碱性增强,去油污能力增强
⑵ 应该铁屑过量(或反应后溶液中必须有铁剩余),否则溶液中可能有Fe3+存在
⑶ 洗涤除去晶体表面附着的硫酸等杂质
用冰水洗涤可降低洗涤过程中FeSO4·7H2O的损耗
⑷ 如图
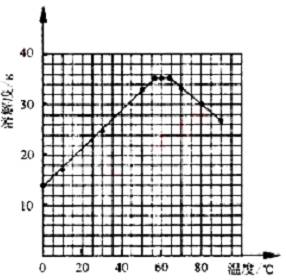
⑸ 56.7℃<t<64℃
【解析】本题主要考查物质制备中应注意的问题及有关溶解度的计算。
(1)废铁屑常沾有油污,可利用水解呈碱性的Na2CO3溶液除去,温度升高,溶液碱性增强,去污效果好,故一般需要加热。(2)废铁屑的表面一般带有铁锈(Fe2O3),若铁屑不足,(反应后的溶液中铁没有剩余),则所得溶液中会含有Fe3+,而使制得的FeSO4·7H2O不纯,故②不合理。(3)在晶体从溶液中析出的过程中一般要吸附杂质离子,故需用水洗涤,而FeSO4的溶解度随温度的升高而增大,故用冷水洗涤可减少FeSO4晶体的损失。(4)根据表中数据不难画出所求图线。(5)分析表中数据可知,析出FeSO4·4H2O的温度范围为高于56.7 ℃而低于64 ℃。


科目:高中化学 来源: 题型:
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
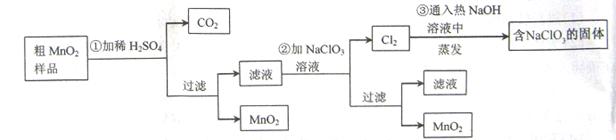
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式
 +
+ ClO3-+
ClO3-+ =
= MnO2+
MnO2+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要 mol NaClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
.铁及铁的化合物应用广泛.如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_______________________________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应___________________ 负极反应________________________
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤__________________________。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时约pH | |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢。但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式__________________________
劣质不锈钢腐蚀的实验现象_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是___________________________________。
(2)铝与氢氧化钾溶液反应的离子方程式是__________________________________。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
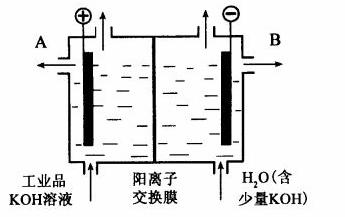
①该电解槽的阳极反应式是__________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因
_______________________________________________________。
③除去杂质后的氢氧化钾溶液从液体出口______(填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
21世纪是全世界大规模开发利用海洋资源、发展海洋经济的新时期。为了人类和平利用海洋资源,今年我国环球科学考察船“大洋一号”首次执行环球大洋科学考察任务。
海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第 族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
食盐+H2O→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是 ;利用电解所得气体制36.5%的浓盐酸1000t,最少需消耗食盐 t。(可能需要的相对原子质量:Na 23 Cl 35.5
H 1 O 16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:
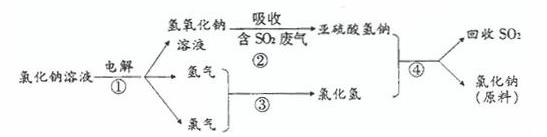
请写出②④的化学反应方程式: 、 。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为:HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有 。(填字母)
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,属于氧化还原反应的是( )。
A.2NaHCO3 Na2CO3+H2O↑+CO2↑
Na2CO3+H2O↑+CO2↑
B.KClO3+6HCl (浓)==KCl+3H2O+3Cl2↑
C.CO2+Ca(OH)==CaCO3↓+H2O
D.MnO2+4HCl (浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )。
A.复分解反应中有的是氧化还原反应,有的不是氧化还原反应
B.置换反应有可能是非氧化还原反应
C.化合反应一定是氧化还原反应
D.分解反应不一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
A.纯盐酸、空气、硫酸、干冰 B.蒸馏水、氨水、碳酸氢钠、二氧化硫
C.胆矾、盐酸、铁、碳酸钙 D.生石灰、漂白粉、氯化铜、碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为 ,CO有多种等电子体,其中常见的一种分子是 。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有 个δ键,C原子的杂化方式为 。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是 ,形成的化学键是 。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
写出A原子的电子排布图 ,Al原子的第一电离能 (填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是 。
(3)下图是一种镍(Ni)镧(La)合金储氢后的晶胞结构图。该合金储氢后,含0.5mol Ni的合金可吸附氢气的体积(标况)为 。
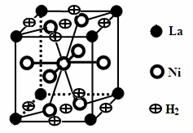
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com