
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。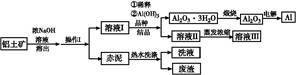
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
科目:高中化学 来源: 题型:填空题
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B =" C" + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为 ;分子的稳定性B M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是 。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是 mol。
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,
①反应是 反应(填“放热”或“吸热”),判断依据是
②若△H =" a" KJ/mol,当消耗标况下5.6 L CO2时的反应热△H = KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是中学阶段常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的转化关系如图所示: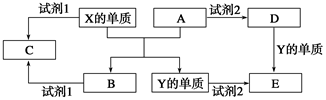
(1)X的单质与A反应的化学方程式是_______________________________。
(2)若试剂1是NaOH溶液,则X的单质与试剂1反应的离子方程式是
___________________________________
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。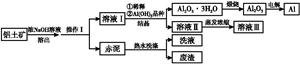
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式) 。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是 。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是 。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号) 。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈现蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是 。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是(各组合中的物质用化学式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”) mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下: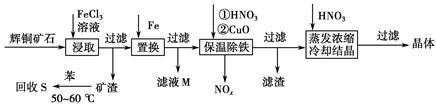
(1)写出浸取过程中Cu2S溶解的离子方程式___________________________。
(2)回收S过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是____________________、____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为______________________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是____________________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
烧结法制氧化铝生产过程如下: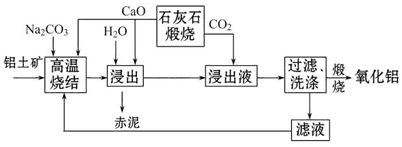
已知:
①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。
②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解的化学方程式____________。
(2)浸出时再加入CaO的目的是______________________________________。
(3)浸出液中发生的生成Al(OH)3的离子方程式为____________________________________。
(4)滤液的主要成分是_________(写化学式);滤液循环使用的优点有________ (任答一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
则镁铝合金中加NaOH溶液的化学反应方程式为 ,金属X是 ,
固体A的化学式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称 ,需要测定的数据有 。(已知该实验时的温度压强)
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为 mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com