
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。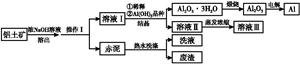
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
科目:高中化学 来源: 题型:填空题
由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下: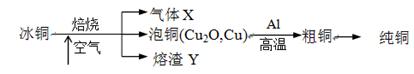
请回答下列问题:
(1)气体X是 。
(2)某研究性学习小组用熔渣Y与CO反应来制取Fe。
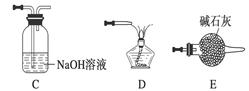
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②装置C的作用是________________。
③在点燃D处的酒精灯前,应进行的操作是__________________。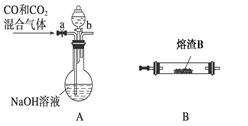
(3)熔渣Y中铁元素的价态有+2价和+3价,根据限选试剂,设计实验方案验证熔渣Y中有+2价铁元素存在,写出有关实验操作、预期现象与结论。
限选试剂: 3 mol·L-1H2SO4、6 mol·L-1HNO3、3% H2O2、0.01 mol·L-1KMnO4、20% KSCN。
。
(4)写出泡铜冶炼粗铜反应的化学方程式 。
(5)根据限选材料画出用粗铜提炼纯铜的装置图,并进行必要的标注。
限选材料:FeSO4(aq)、CuSO4(aq)、粗铁、纯铁、粗铜、纯铜、烧杯、直流电源、导线。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________________。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)____________。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A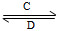 B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:________;D的电子式:________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为________;由A转化为B的离子方程式为______________________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:______________________。A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸铜在工农业生产和生活中都有重要的应用。请回答下列问题:
(1)铜与浓硫酸共热是制备硫酸铜的方法之一,写出反应的化学方程式:__________________。但该反应生成的气体污染环境。为避免环境污染,可在铜粉与稀硫酸的混合物中通入热空气,反应的总化学方程式为____________________。
(2)将铜粉置于稀硫酸中不发生反应,加入双氧水,则铜粉可逐渐溶解。写出反应的离子方程式:____________________。
(3)将适量稀硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶可得到硫酸铜晶体。为了节约原料,H2SO4和HNO3的物质的量之比最佳为________________。
(4)用惰性电极电解硫酸铜溶液,实验装置如图甲所示。图乙是电解过程中产生气体的总体积V与转移电子的物质的量n(e-)的关系图。
电解过程中,a电极的现象是______________;b电极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为________________________________________;
(2)过程Ⅰ加入铁屑的主要作用是__________________,分离得到固体的主要成分是________,从固体中分离出铜需采用的方法是___________________________________;
(3)过程Ⅱ中发生反应的化学方程式为________________________________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为__________________________。(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤: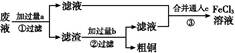
写出一个能证明还原性Fe比Cu强的离子方程式: 。
该反应在上图步骤 中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
| |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。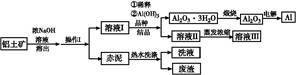
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2 Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),主要工艺流程如下。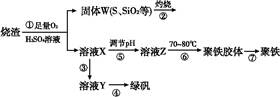
(1)将过程②产生的气体通入下列溶液中,溶液会褪色的是 。
A.品红溶液 B.紫色石蕊试液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS、O2和H2SO4反应的化学方程式为 。
(3)过程③中需加入的物质是 。
(4)过程④中,蒸发结晶时需使用的仪器除酒精灯、三脚架外,还需要 。
(5)过程⑤调节pH可选用下列试剂中的 (填序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是 。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700 0 g样品;②将样品溶于足量的盐酸后,加入过量的BaCl2溶液;③过滤、洗涤、干燥,称重得固体质量为3.495 0 g。若该聚铁的主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸与铜反应制取硫酸铜。该反应的化学方程式是 ,此法的最大缺点是 。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示: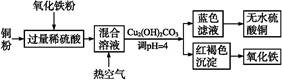
稀硫酸、铜和氧化铁反应的化学方程式是 ;向混合溶液中通入热空气的反应的离子方程式是 ;由滤液得到无水硫酸铜的实验操作是 。
(2)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。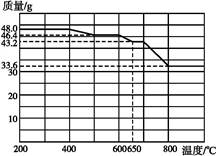
根据图像推断670 ℃时Fe2O3还原产物的化学式为 ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论) 。
仪器自选。可供选择的试剂:稀硫酸、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com