
由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下: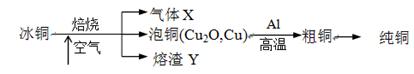
请回答下列问题:
(1)气体X是 。
(2)某研究性学习小组用熔渣Y与CO反应来制取Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②装置C的作用是________________。
③在点燃D处的酒精灯前,应进行的操作是__________________。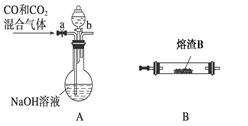
(3)熔渣Y中铁元素的价态有+2价和+3价,根据限选试剂,设计实验方案验证熔渣Y中有+2价铁元素存在,写出有关实验操作、预期现象与结论。
限选试剂: 3 mol·L-1H2SO4、6 mol·L-1HNO3、3% H2O2、0.01 mol·L-1KMnO4、20% KSCN。
。
(4)写出泡铜冶炼粗铜反应的化学方程式 。
(5)根据限选材料画出用粗铜提炼纯铜的装置图,并进行必要的标注。
限选材料:FeSO4(aq)、CuSO4(aq)、粗铁、纯铁、粗铜、纯铜、烧杯、直流电源、导线。
(1)SO2 或二氧化硫(2分)
(2)E→B→C→D(全对2分) ②除去尾气中的CO2(2分)
③检验CO(尾气)的纯度 (2分)
(3)①取少量熔渣Y于试管中,加入适量(经加热煮沸除氧)3 mol·L-1H2SO4溶液(1分),加热充分溶解,反应后得A溶液(1分)。②取少量A溶液,滴加1-2滴0.01 mol·L-1KMnO4溶液,振荡(1分),若溶液的紫红色褪去(1分),则说明熔渣Y中有+2价铁元素存在。
(其他合理即给分)
(4)3Cu2O+2Al 6Cu+ Al2O3 (2分)
6Cu+ Al2O3 (2分)
(5)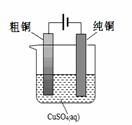 (3分,其中:装置2分,标注1分)
(3分,其中:装置2分,标注1分)
解析试题分析:(1)分析所给的冰铜化学式,其中Cu和Fe焙烧都生成固体氧化物,只有非金属元素S焙烧会生成气体,所以气体X一定是SO2。
(2)①熔渣Y是Fe的氧化物,用CO还原Y制备铁单质,从所给的反应装置来看,B装置是反应制铁装置,通入B中的CO气体不能含有CO2和H2O等杂质气体,因此在A、B之间接上装置E除水;B中反应出来的气体有生成的CO2和过量的CO有毒气体,除CO尾气可用燃烧法,但要注意CO的纯度,防止爆炸,要先用装置C除去尾气中的CO2。所以整个顺序就是A→E→B→C→D。
②装置C的作用是除去尾气中的CO2。
③点燃D处酒精灯除尾气时要验纯。
(3)熔渣Y中的铁元素有+2价和+3价,所以当+2价和+3价Fe元素同时存在时,应该选用高锰酸钾溶液检验其中的+2价铁。
具体步骤:①取少量熔渣Y于试管中,加入适量(经加热煮沸除氧)3 mol·L-1H2SO4溶液,加热充分溶解,反应后得A溶液。
②取少量A溶液,滴加1-2滴0.01 mol·L-1KMnO4溶液,振荡,若溶液的紫红色褪去,则说明熔渣Y中有+2价铁元素存在。
(4)泡铜冶炼粗铜是在高温条件下加入还原剂铝进行冶炼的,所以化学方程式为3Cu2O+2Al 6Cu+ Al2O3 。
6Cu+ Al2O3 。
(5)电解精炼铜是教材中常提到的一个电化学内容,原理比较简单,所以用所提供的材料画出该装置图示比较简单的,但要注意的是各标注要准确。所以图像是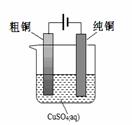
考点:本题考查的是基础实验探究,多以装置连接、气体除杂、尾气吸收为主。


科目:高中化学 来源: 题型:填空题
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下: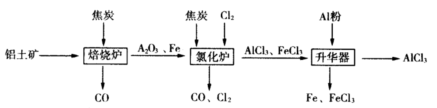
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为 。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式________,与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al): m(Pb)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下面是有关物质的转化关系图(有些物质已省略)。
若A为单质,E在常温下为液体,C的相对分子质量为78。请回答下列问题: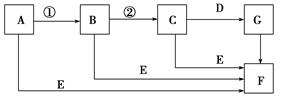
(1)画出A的原子结构示意图________,F的电子式是________。
(2)下面对C物质结构、性质的推断中,不正确的是________。
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键和共价键 |
| D.遇湿润的紫色石蕊试纸只能使其变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图表示的是向Na2CO3溶液中滴入稀盐酸时产生CO2
的过程。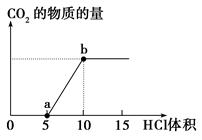
(1)写出a点以前发生反应的离子方程式:_____________________________________
(2)写出a到b点发生反应的离子方程式:_____________________________________
(3)若某Na2CO3溶液中含m mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于________mol(用含字母m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:______________________________________ (列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为______________________,该电池总反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
侯氏制碱法的步骤如下图: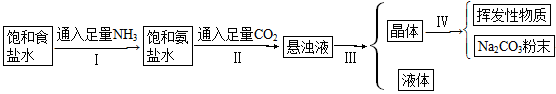
试回答下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合液,则Ⅰ和Ⅱ的总反应为
_______________________________________________
(2)由这一反应可知NaCl比NaHCO3溶解度______________________。
(3)Ⅲ的操作叫____________。
(4)Ⅳ的操作叫____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是中学化学常见的四种物质,它们的转化关系如下: A + B =" C" + D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子
式为 ;分子的稳定性B M(填“>”、“<”或“=”)
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是 。
将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是 mol。
(3)若A、B、C、D发生反应:2CO2(g) + 6H2(g) = CH3CH2OH(g) + 3H2O(g),根据下图所示信息,
①反应是 反应(填“放热”或“吸热”),判断依据是
②若△H =" a" KJ/mol,当消耗标况下5.6 L CO2时的反应热△H = KJ/mol。
③在恒温、恒容的密闭容器中,
下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
A.生成1 mol CH3CH2OH的同时,生成3 mol H2O
B.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被________(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: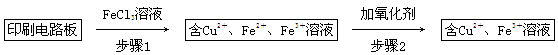

①证明步骤1所加FeCl3溶液过量的方法是_________________________________。
②步骤2中所加的氧化剂最适宜的是______________________________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是________。(写出一种即可)
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) ΔH1=-320 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196 kJ·mol-1
H2(g)+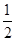 O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的ΔH=________。
(3)欲实现反应Cu+H2SO4=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。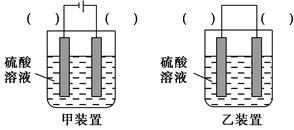
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。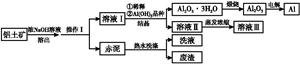
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com