
【题目】I.尿黑酸症是一种引起酪氨酸在人体内非正常代谢的遗传病,酪氨酸在体内有如图转化:

下列说法错误的是(____)
A.酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B.1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2
C.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
D.对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子
II.1,6一己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备。制备G的合成路线如图1:

回答下列问题:
(1)化合物A的质谱图如图2,则A的化学名称为___________。
(2)B→C的反应类型为___________。D→E的反应类型为______________。
(3)F的结构简式为____________。
(4)由G合成尼龙的化学方程式为_______________,与G含有相同官能团的同分异构体有_______种,其中核磁共振氢谱为4组峰,且峰面积比为1:1:2:6的结构简式是___________(写出一种即可)。
由A通过两步反应制备1,3-环己二烯的合成路线为_____________________。
(其它试剂任选,合成路线常用的表示方式为:CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]() )
)
【答案】 D 环己烯 加成反应 氧化反应 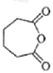
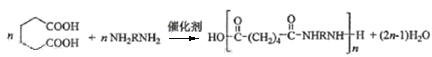 8
8 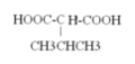 或
或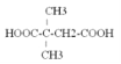
![]()
![]()
![]()
![]()
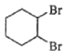
【解析】I.A.酪氨酸中氨基能与盐酸反应,―COOH、―OH能与NaOH溶液反应,故A正确;B.1mol尿黑酸与足量浓溴水反应,酚羟基的邻位可被取代,最多消耗3molBr2 ,故B正确;C.对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个苯环上6个加与苯环相连的1个,故C正确;D.对羟基苯丙酮酸分子核磁共振氢谱有5个峰,无手性碳原子,故D错误;故选D。II.(1)化合物A的质谱图如图2,得A的式量为82,由商余法82/12=6余10,C6H12,结合流程图,则A的化学名称为环已烯;(2)B→C的反应类型为与水发生加成反应;D得氧原子变成E,反应类型为氧化反应;(3)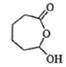 发生氧化反应生成F,F的结构简式为
发生氧化反应生成F,F的结构简式为 ;(4)由G合成尼龙的化学方程式为
;(4)由G合成尼龙的化学方程式为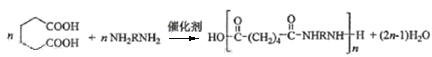 ;与G含有相同官能团的同分异构体有8种,
;与G含有相同官能团的同分异构体有8种, 其中核磁共振氢谱为4组峰,且峰面积比为1:1:2:6的结构简式是
其中核磁共振氢谱为4组峰,且峰面积比为1:1:2:6的结构简式是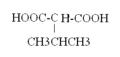 或
或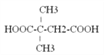 ;由A通过两步反应制备1,3-环己二烯的合成路线为
;由A通过两步反应制备1,3-环己二烯的合成路线为 ![]()
![]()

![]()
![]()


科目:高中化学 来源: 题型:
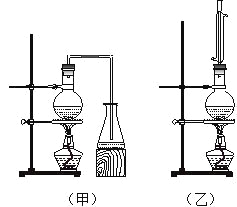
【题目】实验室制取乙酸丁酯的实验装置有如右下图所示两种装置供选用。其有关物质的物理性质
如下表:
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用_______(填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是___________(选填答案编号)。
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国防、工农业等领域发挥着重要作用。工业以甲烷为原料生产氨气的过程如下:![]()
(1)过程Ⅰ中,有关化学反应的能量变化如下图所示

反应①为___________(“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式是________________。
(2)CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ )溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)![]() [Cu(NH3)3]CH3COOCO(1),
[Cu(NH3)3]CH3COOCO(1), ![]()
①N元素在周期表中的位置为__________,NH3的电子式为__________。
②所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是__________(选填字母)。
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
(3)合成NH3的反应为放热反应,如果该反应平衡时,只改变一个条件,再次达到新平衡时,平衡常数K值变大。关于该反应的说法正确的是__________(填字母序号)。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大再减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小再增大
(4)400℃,28MPa时,将1molN2和3mol H2混合充入体积可变的密闭容器中,加入催化剂,10分钟后反应达到平衡时N2转化率为60%。该温度下的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

(5)一种直接供氨式固体氧化物燃料电池能量转化率达85%,其结构示意图如图所示:
①负极的电极反应式是_____________。
②用该电池电解300mL的饱和食盐水。一段时间后,溶液pH=13(忽略溶液体积的变化),则消耗NH3溶液的体积是_____L。(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素位于元素周期表第_______周期______族。AlP遇水蒸气会发生反应放出PH3气体,该反应的另一种产物的化学式为____________。
(2)PH3具有强还原性,能与CuSO4溶液反应,配平该反应的化学方程式:________
□CuSO4+□PH3+□H2O═□Cu3P↓+□H3PO4+□H2SO4
(3)工业制备PH3的流程如图所示。

①黄磷和烧碱溶液反应的化学方程式为_________,次磷酸的化学式为____________,次磷酸属于___________(填“一”“二”或“三”)元酸。
②若起始时有1molP4参加反应,则整个工业流程中共生成 ______ mol PH3.(不考虑产物的损失)
II.某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图所示,电极材料为石墨。

①a表示__________离子交换膜(填“阴”或“阳”)。A-E分别代表生产中的原料或产品。其中C为硫酸,则A表示_____________。E表示___________________。
②阳极的电极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属及其化合物的说法中正确的是
A. 氧化钠和过氧化钠都属于碱性氧化物
B. 豆粒大的金属钠投入到硫酸铜溶液中,析出红色的固体物质
C. 金属钠、镁着火时,可用“干冰”进行灭火
D. 运用铝热反应原理可以冶炼金属铬、锰等难熔金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com