
 NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol•L-1NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
分析 (1)NaH2PO4溶液显弱酸性,说明H2PO4-在水溶液里电离程度大于水解程度;
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度;
(3)①NaH2PO4溶液显弱酸性,应该用酚酞作指示剂;
②碱只能用碱式滴定管量取;
③A中成分是NaH2PO4,能和氢氧化钠反应生成Na3PO4,反应方程式为NaH2PO4+NaOH=Na3PO4+H2O,氢氧化钠的平均体积=$\frac{(21.03-1.02)+(21.99-2.00)+(20.20-0.20)}{3}$mL=20.00mL,根据方程式计算A的物质的量浓度,再根据P原子守恒计算Na5P3O10的质量分数.
解答 解:(1)NaH2PO4溶液显弱酸性,说明H2PO4-在水溶液里电离程度大于水解程度,该阴离子电离方程式为H2PO4-?HPO42-+H+,
故答案为:H2PO4-?HPO42-+H+;
(2)Na2HPO4溶液显弱碱性,说明HPO42-的水解程度大于电离程度,该阴离子水解方程式为HPO42-+H2O?H2PO4-+OH-,
故答案为:HPO42-+H2O?H2PO4-+OH-;
(3)①NaH2PO4溶液显弱酸性,应该用酚酞作指示剂,滴定终点时颜色变化明显,故答案为:酚酞;
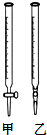
②氢氧化钠溶液呈碱性,应该用碱式滴定管乙盛放,故选乙;
③A中成分是NaH2PO4,能和氢氧化钠反应生成Na3PO4,反应方程式为NaH2PO4+NaOH=Na2HP4+H2O,氢氧化钠的平均体积=$\frac{(21.03-1.02)+(21.99-2.00)+(20.20-0.20)}{3}$mL=20.00mL,根据方程式得c(A)=$\frac{0.1000mol/L×0.02000L}{0.02500L}$=0.0800mol/L,100mL溶液中n(A)=0.008mol,根据P原子守恒得m(Na5P3O10)=0.008mol÷3×368g/mol=0.9813g,质量分数=$\frac{0.9813g}{1.3000g}×100%$=75.5%,
故答案为:75.5%.
点评 本题考查了物质含量的测定及物质的性质,根据物质之间的反应结合原子守恒计算物质含量,计算量较大,注意小数的保留,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等体积、等物质的量浓度的氨水与盐酸混合 | |
| B. | 常温下,pH=8的氨水与pH=6的硝酸等体积混合 | |
| C. | 常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合 | |
| D. | c(H+)=c(OH-)=10-6 mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgI中加一定浓度、一定体积的NaCl溶液,AgI可转化为AgCl | |
| B. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度应该大于$\frac{1}{\sqrt{1.8}}$×10-11mol/L | |
| C. | AgI比AgCl更难溶于水,AgCl可以转化为AgI | |
| D. | 向c(Ag+)=1.8×10-4mol/L的溶液中加入等体积NaCl溶液,开始出现AgCl沉淀,则NaCl溶液浓度应大于1.0×10-6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
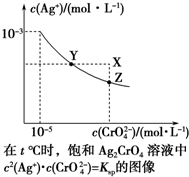 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-11 | |
| B. | 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点 | |
| C. | 在t℃,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO${\;}_{4}^{2-}$(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001 mol•L-1 AgNO3溶液滴定20 mL 0.001 mol•L-1 KCl和0.001 mol•L-1的K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和AgCl水溶液中加入少量的NaCl固体,Ksp(AgCl)变大 | |
| B. | AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| C. | 25℃时,当溶液中c(Ag+)×c(Cl-)=Ksp(AgCl)时,此溶液为AgCl的饱和溶液 | |
| D. | 将固体AgCl加入到浓KI溶液中,部分AgCl转化为AgI,故AgCl溶解度小于AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
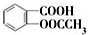 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐为主要原料合成阿司匹林,反应原理如下: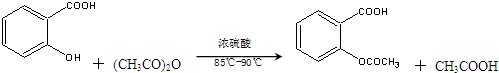
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com