
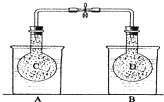
 如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:
如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:| 2g |
| 40g/mol |
| ||
| nmol+2nmol |
| 1.01×105Pa |
| 1.515×105Pa |
| m |
| 184 |
| ||
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2CH2OH
| ||
| B、过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | ||
| C、向CuSO4溶液中滴加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ | ||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O═NaHCO3↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期数 | 族 | 元素符号或原子序数 | |
| (1) | |||
| (2) | |||
| (3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
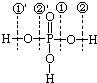 磷酸的结构式可用如图表示.磷酸在一定条件下能发生①号键与②′号键的同时断裂:
磷酸的结构式可用如图表示.磷酸在一定条件下能发生①号键与②′号键的同时断裂:查看答案和解析>>
科目:高中化学 来源: 题型:
A、NaCl的电子式是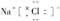 |
| B、炒菜时放入食盐并不破坏NaCl中的化学键 |
| C、加碘食盐中加的是KIO3 |
| D、NaCl溶于水发生电离:NaCl=Na++Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com