
A、NaCl的电子式是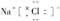 |
| B、炒菜时放入食盐并不破坏NaCl中的化学键 |
| C、加碘食盐中加的是KIO3 |
| D、NaCl溶于水发生电离:NaCl=Na++Cl- |
 ,故A正确;
,故A正确;

科目:高中化学 来源: 题型:
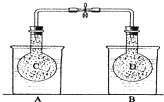 如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:
如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | D | E |
| 性质 结构 信息 | 单质及其盐的焰色反应为紫色(透过蓝色钻玻璃观察) | 工业上用量最大的金属,在潮湿空气中易锈蚀,生成红棕色粉末状物质. | 单质遇淀粉溶液变蓝色. | 单质为双原子分子,常温下是液态,易溶于有机溶剂. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放入氧气中燃烧,检验燃烧产物都是CO2和H2O |
| B、放入银氨溶液中微热,都不发生银镜反应 |
| C、加入浓硫酸后微热,都脱水而变黑 |
| D、分别放入稀酸后煮沸几分钟,用NaOH溶液中和反应后的溶液,再加入新制的Cu(OH)2悬浊液共热,都生成红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
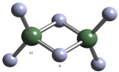 科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )
科技日报2007年1月30日讯:美、德科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定不正确的是( )| A、Al2H6中H为+1价,Al为-3价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6分子是非极性分子 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不同物质的量浓度硫酸等体积混合后,溶液物质的量浓度变为原来和的一半 |
| B、5.6 g铁与足量稀硫酸反应失去的电子的物质的量为0.3 mol |
| C、标准状况下,11.2L NO2气体中含氧原子数等于18 g水中含有的氧原子数 |
| D、20 g NaOH溶于1 L水,所得溶液中c(Na+)=0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cl-的结构示意图: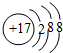 | ||
B、氯化氢分子的电子式: | ||
C、CH4Si的结构式: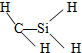 | ||
D、质量数为137的钡原子:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| 含硫反应物的平衡转化率% | 80 | α1 | α2 | α3 | |
| A、乙中SO3的平衡转化率为α1=20% |
| B、平衡时,丙中c(SO3)是甲中的2倍 |
| C、平衡时,α3<α1 |
| D、该温度下,平衡常数的值为400 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com