
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2CH2OH
| ||
| B、过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | ||
| C、向CuSO4溶液中滴加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ | ||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O═NaHCO3↓+NH4+ |
| 浓硫酸△ |


科目:高中化学 来源: 题型:
| A、用25mL量筒量取12.36mL盐酸 |
| B、用托盘天平称取8.75克食盐 |
| C、用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10mL |
| D、用pH试纸测得某溶液的PH为3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10.5% | B、9.5% |
| C、8% | D、5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2S和稀H2SO4 |
| B、K2SO3和盐酸 |
| C、K2S和盐酸 |
| D、K2SO3和稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3分子中含有非极性共价键 |
| B、NF3在空气中泄漏时不易被察觉 |
| C、一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D、反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属性比溴弱 |
| B、H2Se比H2S稳定 |
| C、SeO3对应的水化物是一种酸 |
| D、有-2、+4、+6三种化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3 |
| B、CaCl2 |
| C、ZnCl2 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
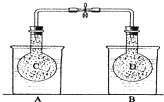 如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:
如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com