
| A、非金属性比溴弱 |
| B、H2Se比H2S稳定 |
| C、SeO3对应的水化物是一种酸 |
| D、有-2、+4、+6三种化合价 |


科目:高中化学 来源: 题型:
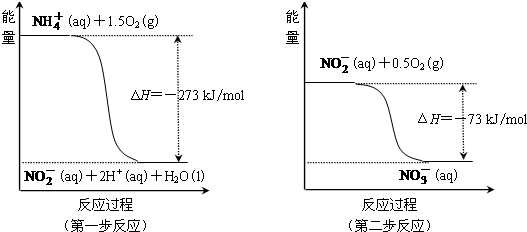
| Ⅰ |
| Ⅱ |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用浓硫酸与4-溴-1-丁醇加热发生消去反应:BrCH2CH2CH2CH2OH
| ||
| B、过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | ||
| C、向CuSO4溶液中滴加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ | ||
| D、用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O═NaHCO3↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液和醋酸反应:2H++CO32-═CO2↑+H2O |
| B、Na2S水解:S2-+2H2O═H2S+2OH- |
| C、镁粉撒入NH4Cl溶液:Mg+2H+═Mg2++H2↑ |
| D、Mg(HCO3)2溶液和足量NaOH溶液反应:Mg2++4OH-+2HCO3-═Mg(OH)2↓+2CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
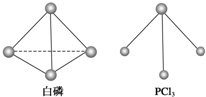 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.| 5 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期数 | 族 | 元素符号或原子序数 | |
| (1) | |||
| (2) | |||
| (3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com