
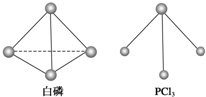
 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.| 5 |
| 4 |
| 1 |
| 4 |
| 5 |
| 4 |
| 1 |
| 4 |
| 62g |
| 31g/mol |
| 50.4L |
| 22.4L/mol |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A、元素周期表含元素最多的族是第ⅢB族 |
| B、元素周期表有18个族 |
| C、第ⅠA族的元素全部是金属元素 |
| D、短周期是第一、二、三、四周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3分子中含有非极性共价键 |
| B、NF3在空气中泄漏时不易被察觉 |
| C、一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D、反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属性比溴弱 |
| B、H2Se比H2S稳定 |
| C、SeO3对应的水化物是一种酸 |
| D、有-2、+4、+6三种化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
60 27 |
60 27 |
A Z |
0 -1 |
60 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3 |
| B、CaCl2 |
| C、ZnCl2 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后
| ||||||
| B、参加反应的氯气的物质的量等于3a mol | ||||||
| C、改变温度,反应中转移电子的物质的量ne的范围:3a mol<ne<5a mol | ||||||
| D、改变温度,产物中KClO3的最大理论产量为a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

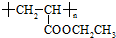 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com