
60 27 |
60 27 |
A Z |
0 -1 |
60 27 |
60 27 |
60 27 |
A Z |
0 -1 |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| A、节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| B、小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| C、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 |
| D、面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于过氧化物,过氧化苯甲酰属于有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②③ | C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40g NaOH溶于1L水所得的溶液 |
| B、将0.5mol?L-1的NaNO3溶液100mL加热蒸发掉50g水所得的溶液 |
| C、将23g Na溶于水并配成1L的溶液 |
| D、从1L 2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
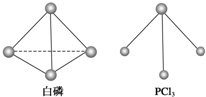 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10.| 5 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 性质 | 氧(8O) | 硫(16S) | 硒(34Se) | 碲(52Te) | |
| 单质熔点(℃) | -218.4 | 113 | 450 | ||
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 | |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ||
| 原子半径 | 逐渐增大 | ||||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 能直接化合 | |

查看答案和解析>>
科目:高中化学 来源: 题型:
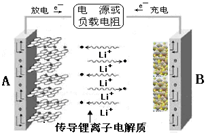 锂离子电池是具有电压高、能量密度大、循环性能好等突出优点的高效绿色产品.某锂离子电池的结构如右图所示,以石墨化的碳、氧化钴锂(LiCoO2)为电极,当充电时,阳极上发生的电极反应为LiCoO2-xe-=Li1-xCoO2+xLi+,总反应式为LiCoO2+6C=Li1-xCoO2+LixC6.
锂离子电池是具有电压高、能量密度大、循环性能好等突出优点的高效绿色产品.某锂离子电池的结构如右图所示,以石墨化的碳、氧化钴锂(LiCoO2)为电极,当充电时,阳极上发生的电极反应为LiCoO2-xe-=Li1-xCoO2+xLi+,总反应式为LiCoO2+6C=Li1-xCoO2+LixC6.| 充电 |
| 放电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com