
【题目】材料是人类赖以生存和发展的重要物质基础。请回答下列问题:
(1)有机合成材料的出现是材料发展史上的一次重大突破。人们常说的三大合成材料是指__________________、__________________、__________________。
(2)聚氯乙烯的商品名为PVC,其结构简式为____________________,PVC管材中还需要加入具有特殊用途的添加剂,如_______________、________________等,因为PVC具有_____________性,所以由它制得的材料可反复加工、多次使用。
(3)合金是生活中常见的材料,某合金具有密度小、强度高的优良性能,常用于制造门窗框架,该合金中含量最高的金属为_______(填元素符号),该元素在周期表中的位置为______________________________。
(4)玻璃是一种常见的硅酸盐材料,制备普通玻璃的原料有CaCO3、_______和_______。
【答案】 塑料 合成纤维 合成橡胶 ![]() 增塑剂 防老化剂 热塑 Al 第三周期第ⅢA族 Na2CO3 SiO2
增塑剂 防老化剂 热塑 Al 第三周期第ⅢA族 Na2CO3 SiO2
【解析】(1)三大合成材料是指:塑料、合成纤维和合成橡胶。
(2)聚氯乙烯是氯乙烯加聚的产物,其结构简式为![]() 。由聚氯乙烯制备PVC管材的过程中,一般需要添加增塑剂和防老化剂(或者说抗老化剂)以改善其性能。因为聚氯乙烯是热塑型的塑料,所以由它制得的材料可反复加工、多次使用。
。由聚氯乙烯制备PVC管材的过程中,一般需要添加增塑剂和防老化剂(或者说抗老化剂)以改善其性能。因为聚氯乙烯是热塑型的塑料,所以由它制得的材料可反复加工、多次使用。
(3)某合金具有密度小、强度高的优良性能,常用于制造门窗框架,所以该合金是铝合金。由此得到该合金中含量最高的金属为Al。Al在周期表中的位置为第三周期ⅢA族。
(4)普通玻璃是由碳酸钙、二氧化硅和碳酸钠加强热制取的,


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】据报道,以NaBH4(B为+3价)和H2O2做原料的新型燃料电池可用作深水勘探等无空气环境下的电源,其结构如右图所示.该电池总反应式为:NaBH4+4H2O2=NaBO2+6H2O,下列的说法正确是( )
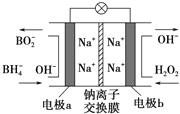
A. 放电过程中,Na+从右向左迁移
B. a为正极,其电极反应为:BH4--8e-+8OH-=BO2-+6H2O
C. b电极的电极反应式为:H2O2+2e-+2H+=2H2O
D. 每消耗300g、34%的H2O2溶液,理论上流过电路中的电子数为6NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为 Fe2O3 和 Fe3O4)制备 PFS,其工艺流程如下图所示。
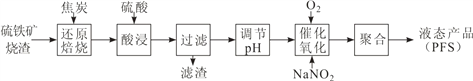
(1)CO是“还原焙烧”过程的主要还原剂。下图中,曲线表示 4 个化学反应 a、b、c、d 达到平衡时气相组成和温度的关系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别是 Fe2O3、Fe3O4、FeO、Fe 稳定存在的区域。a属于__________(填“吸热反应”或“放热反应”);570℃时,d 反应的平衡常数 K=___________________。
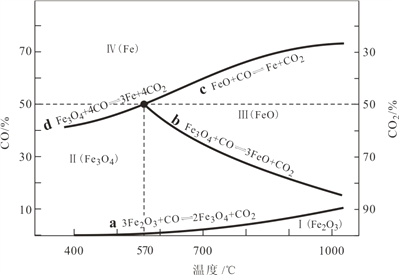
(2)800℃,混合气体中CO2的体积分数为40%时,Fe2O3用CO还原焙烧过程中发生的主要的化学反应方程式:________________________________________________
(3)若“酸浸”时间过长,浸出液 Fe2+含量反而降低,主要原因是___________________。
(4)已知:25℃时,Ksp[Fe(OH)2]=1.0×10-17,Ksp[Fe(OH)3]=1.0×10-39。若浸出液中c(Fe3+) = 10-1.8mol·L-1,为避免“催化氧化”过程中产生副产物 Fe(OH)3,应调节浸出液的 pH≤___________。
(5)FeSO4 溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4 ,该反应的离子方程式_____________________________________.
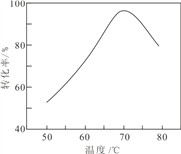
(6)“催化氧化”过程中,用 NaNO2 作催化剂(NO 起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+ 转化率随温度的升高先上升后下降的原因是___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
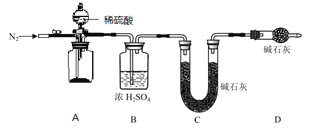
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.在熔融状态下和溶解于水时均不导电的化合物,叫做非电解质
B.电解质、非电解质都对化合物而言,单质不在此范畴
C.在水中的电解质一定都导电性很强
D.水是极弱的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应2SO2+O22SO3,下列有关说法正确的是
A.使用催化剂能加快反应速率B.降低温度能加快反应速率
C.增大反应物浓度能减慢反应速率D.SO2、O2能100%转化为产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
![]() (浓)
(浓)![]()
![]()
试完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______(用字母代号填写)
a.酸 b. 碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)该反应中被氧化的元素是_________________,参加反应的氧化剂与还原剂的物质的量之比为______。
(3)写出该反应的化学方程式并用双线桥标出电子转移的方向和数目:____________。
(4)一定量的铜片与100mL 18 mol/L的浓![]() 充分反应,如果该反应过程中转移了0.2mol电子,生成的
充分反应,如果该反应过程中转移了0.2mol电子,生成的![]() 的质量为_________g,生成的A气体在标准状况下体积为________L(假设气体全部逸出)。
的质量为_________g,生成的A气体在标准状况下体积为________L(假设气体全部逸出)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1H3AsO3溶液中逐滴加入KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。下列说法正确的是( )
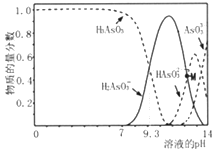
A. H3AsO3的电离常数Ka1的数量级为10-9
B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com