
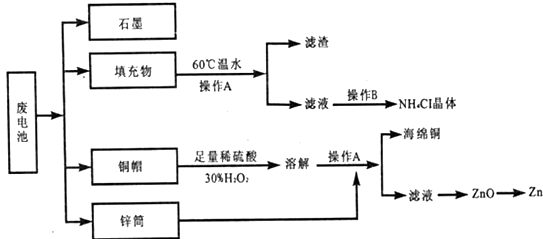

分析 废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌.
(1)加热适当温度,可促进溶解,注意温度不能过高,否则氯化铵易分解;
(2)操作A用于分离和固体和液体,为过滤操作;
(3)酸性条件下,双氧水能将铜氧化生成铜离子;加热条件下,双氧水易分解;
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2,其负极上锌失电子发生氧化反应;
(5)①反应中二氧化锰中Mn元素化合价由+4价降低为+2价,而MnO(OH)中Mn元素化合价由+3价降低为+2,H2C2O4最高C元素化合价升高,据此参加反应MnO(OH)的物质的量,结合Mn元素化合价变化计算转移电子;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水;
(6)根据横坐标与其吸收率曲线变化趋势分析;酸性条件下,高锰酸钾具有强氧化性.
解答 解:废旧干电池含有铜、石墨、二氧化锰以及填充物等,填充物用60℃充分溶解,过滤,滤液中含有氯化铵,蒸发、浓缩、结晶可得到氯化铵晶体;铜与稀硫酸在过氧化氢作用发生氧化还原反应生成硫酸铜,加入锌可置换出铜,过滤分离,硫酸锌溶液最终可生成氢氧化锌、氧化锌,冶炼可得到锌.
(1)加热适当温度,可促进溶解,注意温度不能过高,否则氯化铵易分解,
故答案为:加快溶解速率;
(2)分离不溶性固体和溶液采用过滤的方法,所以该操作名称是过滤,
故答案为:过滤;
(3)酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热,
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热;
(4)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OH--2e-=Zn(OH)2,
故答案为:Zn+2OH--2e-=Zn(OH)2;
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2 MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①反应中二氧化锰中Mn元素化合价由+4价降低为+2价,而MnO(OH)中Mn元素化合价由+3价降低为+2,H2C2O4最高C元素化合价升高,当1mol MnO2参加反应时,参加反应MnO(OH)的物质的量2mol,结合Mn元素化合价变化,可知转移电子为1mol×2+2mol×1=4mol,
故答案为:4;
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水,反应方程式为:2MnO(OH)+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+Cl2↑+4H2O,
故答案为:2MnO(OH)+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2MnCl2+Cl2↑+4H2O;
(6)①根据图象知,随着pH的增大,汞的吸收率先先降低后增加,故答案为:先降低后增加;
②酸性条件下,高锰酸钾具有强氧化性,所以酸性条件下的高锰酸钾氧化性更强,故答案为:氧化性.
点评 本题以废电池中资源回收为载体,考查了物质的分离和提纯、原电池原理、氧化还原反应等,能从整体上把握物质分离过程,熟练掌握基础知识并能灵活运用,题目难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 若T的最低化合价为-3,则J的最高正化合价为+6 | |
| B. | 若HnJOm为强酸,则G是位于ⅤA以后的活泼非金属元素 | |
| C. | 若M(OH)n+1为强碱,则R(OH)n也为强碱 | |
| D. | 若M的最高正化合价为+4,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>C | B. | 气态氢化物的稳定性HA>H2B>H3C | ||
| C. | 阴离子还原性C3->B2->A- | D. | 非金属性A>B>C |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.摩尔是化学上常用的一个物理量
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列关于实验基本操作的叙述,不正确的是
A. 用蒸发皿进行加热蒸发时,不需要垫加石棉网即可直接进行加热
B. 蒸馏实验中,要在烧瓶中加入几粒沸石或碎瓷片,以防止液体发生局部过热而暴沸
C. 蒸馏时,冷凝水应从冷凝管上口进,下口出
D. 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、Cl2、N2、酸雨 | B. | SO2、NO2、可吸入颗粒物 | ||
| C. | NH3、CO2、NO2、雾 | D. | HCl、SO2、N2、可吸入颗粒物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
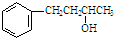 的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )
的名称为4-苯基-2-丁醇.下列关于有机物的说法中,正确的是( )| A. |  的名称为3-苯基-2-丙醇 的名称为3-苯基-2-丙醇 | |
| B. | 4-苯基-2-丁醇与 互为同系物 互为同系物 | |
| C. | 4-苯基-2-丁醇分子中的所有碳原子一定共平面 | |
| D. | 4-苯基-2-丁醇的核磁共振氢谱共有8个峰 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A.(a-2b-2c) kJ·mol-1
B.(2b+2c-a) kJ·mol-1
C.(b+c-a) kJ·mol-1
D.(a-2b-c) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com