
| A. | 若T的最低化合价为-3,则J的最高正化合价为+6 | |
| B. | 若HnJOm为强酸,则G是位于ⅤA以后的活泼非金属元素 | |
| C. | 若M(OH)n+1为强碱,则R(OH)n也为强碱 | |
| D. | 若M的最高正化合价为+4,则五种元素都是非金属元素 |
分析 同周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,结合元素在周期表中的相对位置结合元素对应的单质、化合物的性质解答该题.
解答 解:A.若T的最低化合价为-3,如T为N元素,则J为F元素,无正价,故A错误;
B.若HnJOm为强酸,如J为Cl元素,则G可能为Si或P,为不活泼非金属元素,故B错误;
C.同周期元素从左到右元素的金属性逐渐减弱,若M(OH)n+1为强碱,则R(OH)n一定为强碱,故C正确;
D.以上元素不一定为短周期元素,如M为Sn元素,则T为Sb元素,为金属元素,故D错误.
故选C.
点评 本题考查同周期元素的性质的递变规律,题目难度不大,本题注意把握同周期元素的性质的递变规律和在元素周期表中的可能位置.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
 氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.
氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(Na)>r(Mg)>r(Al)>r(K) | B. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | ||
| C. | r(Na)>r(K)>r(Ca)>r(Mg) | D. | r(F-)>r(Na+)>r(Mg2+)>r(Al3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1-苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1-苯乙醇的反应原理、装置和有关数据如下:
1-苯乙醇具有柔和、愉快而持久的玫瑰香气,广泛用于各种食用香精和烟用香精中.实验室以苯乙酮和硼氢化钠为原料制备1-苯乙醇的反应原理、装置和有关数据如下:| 试剂 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 | ||
| 水 | 乙醇 | 乙醚 | ||||
| 1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
| 苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
| 硼氢化钠 | - | - | 1.076 | 溶 | 溶 | 不溶 |
| 乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
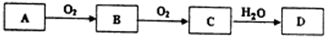
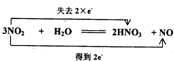
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
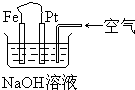
| A. | 这是电解NaOH溶液的装置 | |
| B. | Pt为正极,其电极反应为:O2+2H2O+4eˉ═4OHˉ | |
| C. | Fe为阳极,其电极反应为:Fe-2eˉ+2OHˉ═2Fe(OH)2 | |
| D. | 这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
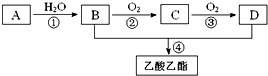
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
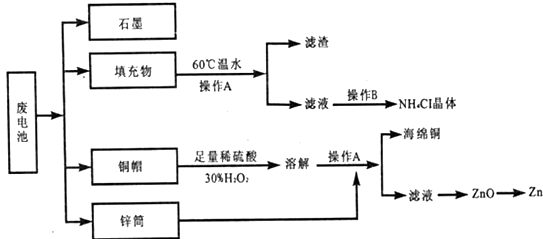

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com