
A—G都是有机物,它们的转化关系如下:
请回答下列问题:
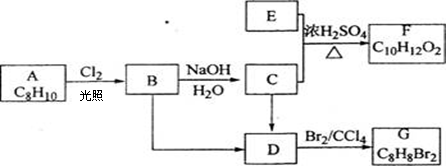 |
(1)已知:6.0g化合物E完全燃烧生成8.8gCO2和3.6gH2O,E的蒸汽与氢气的相对密度为30,则E的分子式为 。
(2)A为一取代芳烃,B中含有一个甲基,由B生成C的化学方程式为
(3)写出下列转化的化学方程式:
B→D
E+C→F
(4)上述过程中转化得到的F有多种同分异构体,同时符合下列条件的F的同分异构体有 种。
①苯环上只有两个邻位取代基,其中一个为甲基 ②与F具有相同的官能团。
其中1mol某符合上述条件的有机物,与氢氧化钠溶液反应时消耗2mol氢氧化钠,其反应方程式:
科目:高中化学 来源: 题型:
现用18.4 mol·L-1的浓硫酸来配制480mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④药匙 ⑤托盘天平⑥量筒
(1)上述仪器在配制过程中不需要用到的是__________________。(填序号)除上述仪器外,尚缺最重要的仪器是 。
(2)需要用量筒量取浓硫酸的体积为___________mL。
(3)实验中用到玻璃棒,其作用分别是:___________、__________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。
其正确的操作顺序为:②→①→③→____ →____→____→____→④(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏低的有____________(填序号)
①定容时,仰视刻度线。
②未冷却至室温就转移到容量瓶中。
③容量瓶中含有少量蒸馏水。
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒。
⑤定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线。
(6)取所配制的稀硫酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.224L,则参加反应的锌的质量为 g,设反应后溶液的体积仍为100mL,则反应后溶液中H+的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是
A.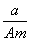 (A-N)mol B.
(A-N)mol B.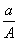 (A-N)mol C.
(A-N)mol C.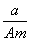 (A-N+m)mol D.
(A-N+m)mol D. 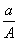 (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2 (g) 2AB2 (g)的ΔH<0,下列说法正确的是( )
2AB2 (g)的ΔH<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中,能大量共存的一组离子是
A.pH=1的溶液中:NH4+ 、 Fe2+ 、SO42-、Cl-
B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+
C.c(Al3+)=0.1 mol/L的溶液中 :Na+、K+、AlO2-、SO42-
D.由水电离出的c(H+)=1×10-13 mol/L 的溶液中:Na+、HCO3-、Cl-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
右表为元素周期表短周期的一部分.下列有关W、X、Y、Z四种元素的叙述中,正确的是
A.YO2能使紫色石蕊试液先变红后褪色
B.将W的氧化物溶于水可得W的含氧酸
C.X的氢化物沸点比W的氢化物的沸点高
D.Y的阴离子电子层结构与Z原子的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
有某种含有少量FeCl2杂质的FeCl3样品。现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量mg样品(在2—3g范围内):
②向样品中加入10mL 6 moL·L-1的盐酸,再加入蒸馏水,配制成250mL溶液:
③量取25mL操作②中配得的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全:
⑤过滤,将沉淀洗涤后,移至坩埚,灼烧、冷却、称重,并重复操作至恒重。
试回答下列问题:
(1)溶解样品时,要加入盐酸,原因是 ;
(2)加入氯水后,反应的离子方程式为 ;
(3)加入过量氨水生成沉淀的离子方程式为 ;
(4)若不用氯水,可用下列试剂中的 代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(5)步骤⑤中检验沉淀是否洗净的方法是 。
(6)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 (请把结果约到最简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com