
【题目】硫及硫化物广泛存在于自然界中,回答下列问题:
(1)基态S原子中,核外电子占据的最高能层的符号是___________,有__________种不同形状的电子云。
(2)(NH4)2SO4中O、N、S三种元素的第一电离能的大小关系为_______________________。
(3)中学化学常用KSCN检验Fe3+,列举一种与SCN-互为等电子体的分子:___________,SCN-中C原子的杂化方式为_________________。
(4)乙硫醇(CH3CH2SH)的相对分子质量比CH3CH2OH大,但乙醇的沸点高于乙硫醇的原因是_________________________________________________。
(5)PbS是一种重要的半导体材料,具有NaC1型结构(如图),其中阴离子采用面心立方最密堆积方式,X-射线衍射实验测得PbS的晶胞参数为a=0.594 n m。
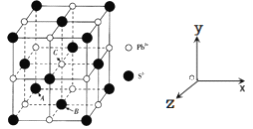
①已知坐标参数:A(0,0,0),B![]() ,则C的坐标参数为__________________。
,则C的坐标参数为__________________。
②PbS晶体中Pb2+的配位数为_________,r(S2-)为______nm。(已知![]() )
)
③PbS晶体的密度为_________g·cm-3。(列出计算式即可)
【答案】 M 2 N>O>S CO2、CS2、N2O、COS等 sp 乙醇分子间存在氢键 (![]() ,
,![]() ,
,![]() ) 6 0.210
) 6 0.210 ![]()
【解析】(1)S为16号元素,基态S原子核外有3个电子层,核外电子占据的最高能层的符号是M,核外有s、p2种不同形状的电子云,故答案为:M;2;
(2) 同周期,第一电离能总体呈现从左至右逐渐增大的变化趋势;同主族,从上至下第一电离能逐渐减小。但N的2p为半充满结构,均为稳定,因此O、N、S三种元素的第一电离能的大小关系为N>O>S,故答案为:N>O>S;
(3)与SCN-互为等电子体的分子有CO2、CS2、N2O等,SCN-的结构与二氧化碳相似,C原子的杂化方式与二氧化碳中的C原子的杂化方式相同,为sp杂化,故答案为:CO2、CS2、N2O、COS等;sp;
(4) 乙醇分子间存在氢键,而乙硫醇(CH3CH2SH) 分子间不存在氢键,导致乙醇的沸点高于乙硫醇,故答案为:乙醇分子间存在氢键;
(5)①根据图示,A(0,0,0),A为坐标原点,B![]() ,B在底面的中心,则边长为1,C在体心,因此C的坐标参数为(
,B在底面的中心,则边长为1,C在体心,因此C的坐标参数为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );
);
②在PbS晶胞中Pb2+与周围的6个S2-的距离相等且最小,配位数为6;晶胞中S2-采用面心立方最密堆积方式,晶胞参数为a=0.594 n m,则4r(S2-)=![]() ×0.594nm,解得r(S2-)=0.210 nm,故答案为:6;0.210;
×0.594nm,解得r(S2-)=0.210 nm,故答案为:6;0.210;
③PbS晶胞具有NaC1型结构,PbS晶胞中含有阴阳离子数目相等,如S2-的个数=12×![]() +1=4,,则晶体的密度=
+1=4,,则晶体的密度=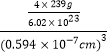 =
=![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】pH=0的某X溶液中,除H+外,还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量X溶液进行如下一系列实验:

下列有关判断不正确的是( )
A. 生成气体A的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
B. 生成沉淀H的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C. 溶液X中一定没有的离子仅为:CO32-、Ba2+
D. 溶液X中一定含有的离子是:H+、Fe2+、SO42-、NH4+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,体积均为1L的HA、HB的两种一元酸溶液,分别向其中加水稀释至体积V,pH随lgV的变化关系如图所示。下列说法正确的是
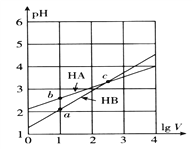
A. HA是弱酸,HB是强酸
B. 相同温度、相同浓度的NaA、NaB溶液的pH,后者大
C. c点处,分别加入足量的锌粒,HA中产生氢气多
D. a、b、c三点,由水电离出来的c(H+)·c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

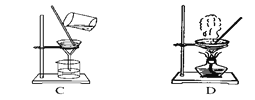
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);
(2)除去自来水中的Cl-等杂质,选择装置A,装置A中①的名称是________,进水的方向是从________口进水。实验时A中除加入少量自来水外,还需加入少量碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补 B.冷却后补加 C.不需补加 D.重新配料
收集完蒸馏水后,是先撤酒精灯还是先停冷凝水?_________________________。A中不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(3)①从碘水中分离出I2,可以选择以下哪种萃取剂_____________;
A.酒精 B.苯 C.汽油 D.食盐水
②该分离方法的名称为________。
③分液漏斗在使用前须清洗干净并________;
④在选择以上萃取剂时,本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。装置B在分液时为使液体顺利滴下,除打开旋塞外,还应进行的具体操作是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组分散系:①汽油和水形成的乳浊液、②含有泥沙的食盐水、③溶有碘(I2)的碘化钾溶液、④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表)。

请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )

A. ①﹣(3)﹣分液
B. ②﹣(2)﹣过滤
C. ③﹣(2)﹣萃取
D. ④﹣(1)﹣蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要制备纯净的氯化钾。现含有少量K2SO4的氯化钾样品,按照如图所示的实验方案进行提纯。

(1)检验加入BaCl2溶液后![]() 是否沉淀完全的操作为____________________________。
是否沉淀完全的操作为____________________________。
(2)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由:_____________________。
(3)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,他的思路如下:

请写出①②③④⑤溶质或沉淀的化学式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料生产铝和氮化铝的一种工艺流程如下[已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀]。

(1)操作I、Ⅱ的名称为____________。
(2)用氧化物的形式表示铝硅酸钠的化学式_____________。
(3)杂质Fe2O3最后存在于___________中。
(4)工业制备Al的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下CH3COOH的电离常数为1.7×10-5,该温度下用0.1mol·L-1的醋酸溶液滴定10.00mL等物质的量浓度的碱ROH,滴定过程中加入醋酸的体积(V)与溶液中![]() 的关系如图所示。下列说法中正确的是
的关系如图所示。下列说法中正确的是
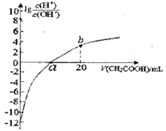
A. b点溶液显碱性
B. a>10.00
C. ROH的电离方程式为ROH![]() R++OH-
R++OH-
D. 25℃时,1mol·L-1的醋酸溶液中CH3COO-的浓度约为4.12×10-2mol·L-1(已知![]() =4.12)
=4.12)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com