
【题目】实验室用MnO2和浓盐酸制氯气:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
(1)该反应中氧化剂和氧化产物的物质的量之比为_________。
(2)该反应中,若有0.2 mol HCl被氧化,能生成标准状况下Cl2的体积为________L。
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
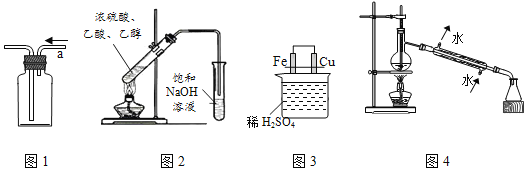
A. 用图1从a口进气可收集乙烯 B. 用图2制取并收集乙酸乙酯
C. 用图3比较Fe、Cu的金属活动性 D. 用图4进行石油的蒸馏实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解NaHSO4溶液制备Na2S2O8。电解时,阴极材料为Pb;阳极(铂电极)电极反应式为2HSO4-- 2e-=S2O82-+2H+。下列说法正确的是( )
A. 阴极电极反应式为Pb+HSO4-- 2e-=PbSO4+H+
B. 阳极反应中S的化合价升高
C. S2O82-中既存在非极性键又存在极性键
D. 可以用铜电极作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图Ⅰ)顶点的氮原子,这种碳氮化钛化合物的化学式为___。
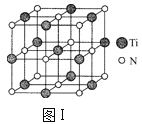
(2)图Ⅱ是由Q、Cu、O三种元素组成的一种高温超导体的晶胞结构,其中Cu为+2价,O为-2价,则Q的化合价为___价。
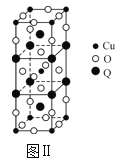
(3)一种新型阳极材料LaCrO3的晶胞如图Ⅲ所示,已知距离每个Cr原子最近的原子有6个,则图Ⅲ中___(填字母)原子代表的是Cr原子。
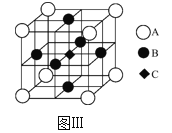
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+转化为Fe3+,下列物质可作氧化剂的是__(填字母)。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液pH至4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用___(填字母)。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液pH至4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1.0×10-5mol·L-1时就被认定为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5mol·L-1]时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO42-、SO32-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图。下列有关推断不正确的是( )
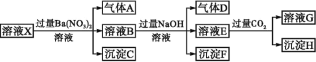
A.溶液X中一定含有NH4+、Al3+、H+、Fe2+、SO42-
B.根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl-
C.沉淀H为Al(OH)3、BaCO3的混合物
D.若溶液X为100 mL,产生的气体A为44.8 mL(标准状况),则X中c(Fe2+)=0.06 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属混合物粉末15g,与足量的盐酸反应生成标准状况下11.2L氢气,符合上述情况的金属混合物是( )
A.Mg、FeB.Zn、AgC. Fe、ZnD.Mg、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验。(a、b为弹簧夹,其他装置略去)
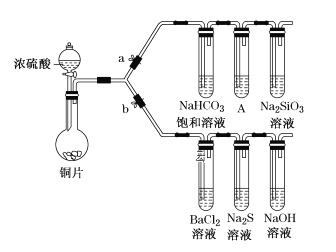
Ⅰ.验证酸性的相对强弱:碳酸>硅酸。(已知酸性:亚硫酸>碳酸)
(1)铜与浓硫酸反应的化学方程式是________________,装置A中的足量的试剂是________________。
(2)连接仪器、__________、加药品后,打开a关闭b,然后滴入浓硫酸,加热。能说明碳酸的酸性比硅酸酸性强的实验现象是__________________。
Ⅱ.验证SO2具有氧化性、还原性和酸性氧化物的通性。
(3)打开b,关闭a,能验证SO2具有氧化性的化学方程式是________________
(4)若过量的SO2通入NaOH溶液中,其化学方程式是____。
(5)BaCl2溶液中无任何现象,将其分成两份,分别滴加氨水和氯水,均产生白色沉淀,沉淀化学式是_____________________。其中SO2显示还原性并生成白色沉淀的总的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
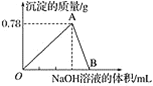
(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com