
【题目】现有NO2、O2的混合气体12 mL,通入足量水中,充分反应后剩余气体2 mL(同温同压下),则原混合气体中氧气的体积是( )
A.1.3 mLB.2.4 mLC.3 mLD.4 mL或1.2 mL
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中导电性最强的是( )
A. 1 L 0.1 mol/L AlCl3溶液 B. 0.1 L 0.1 mol/L H2SO4溶液
C. 0.5 L 0.15 mol/L盐酸 D. 2 L 0.1 mol/L H2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O===FeCl3·6H2O。

(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序):
①接_______________________________________________________
(2)烧瓶A发生的反应中,氧化剂是________(填物质名称),B中反应的化学方程式是___________________。
(3)容器D的作用是_____________________________________________,容器E的作用是__________________________________________________。
(4)A、B中的酒精灯应先点燃________处(填“A”或“B”)的酒精灯,理由是___________________。
(5)这套实验装置是否完整?________(填“是”或“否”),若不完整,还须补充________装置(若第一问填“是”,则此问不需要作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,互为同分异构体的是 ( )
A. 与
与
B. 与CH3CH2CH2CH2Cl
与CH3CH2CH2CH2Cl
C.CH4与CH3CH3
D.CH3CH(CH3)CH2CH2CH3与CH3CH2CH2CH(CH3)CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或数据合理的是
A. 工业上常用热还原法冶炼铁和钠
B. 用NaOH溶液能一次鉴别分别含有Mg2+、Cu2+、和Na+的三种盐溶液
C. 从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤: 溶解→过滤→蒸馏
D. 量取16.80mLNa2CO3溶液可选用规格为20mL的量筒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X) < Mr(Y)= 0.5Mr(Z),下列说法正确的是()
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件下,同质量的三种气体,气体密度最小的是X
C.若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D.同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH增大
C. 滴加新制氯水,平衡向左移动,溶液pH减小
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学测定盐酸的浓度在实验室中进行实验。请完成下列填空:
(1)配制100![]() 0.10
0.10![]() 标准溶液。
标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)→洗涤(并将洗涤液移入容量瓶) →__________ →__________ →__________→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量__________![]() 氢氧化钠固体所需仪器有:天平(带砝码、镊子)、__________、__________。
氢氧化钠固体所需仪器有:天平(带砝码、镊子)、__________、__________。
(2)取20.00 ![]() 待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的
待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的![]() 标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
实验编号 |
| 滴定完成时, | 待测盐酸的体积/ |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
① 滴定达到终点的标志是__________。
② 根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)。
③ 排除碱式滴定管中气的方法应采用如图所示操作中的__________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
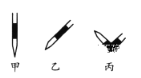
④ 在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有__________(填字母序号)。
A. 滴定终点读数时俯视
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 称量的![]() 固体中混有
固体中混有![]() 固体
固体
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝分别和O2、O3发生反应生成Al2O3,反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。下列有关说法中不正确的是

A. Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)![]() Al2O3(s) ΔH =-1559.5 kJ·mol-1
Al2O3(s) ΔH =-1559.5 kJ·mol-1
B. 等质量的O2比O3的能量低
C. 1 mol O2完全转化为O3,需吸收142 kJ的热量
D. 给3O2(g)![]() 2O3(g)的平衡体系加热,有利于O3的生成
2O3(g)的平衡体系加热,有利于O3的生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com