
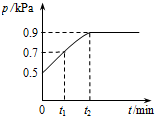
 在1.0L密闭容器中放入0.10molX,在一定温度下发生反应:X(g)═Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10molX,在一定温度下发生反应:X(g)═Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=0.32 | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
分析 A.在恒容容器中,气体的压强之比等于物质的量之比,利用三段式法计算P为0.7KPa时,反应掉X的物质的量求算;
B.在恒容容器中,气体的压强之比等于物质的量之比,利用三段式法计算平衡状态时即P为0.9KPa时各物质的浓度,求算K;
C.提高Y的含量,应该使平衡向着正向移动,结合该反应为放热反应分析;
D.恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低.
解答 解:A.设反应的X物质的量为x,
X(g)?Y(g)+Z(g)
起始量(mol) 0.10 0 0
转化量(mol) x x x
0.7KPa量(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,有$\frac{0.10-x+x+x}{0.1}$=$\frac{0.7}{0.5}$,解得:x=0.04,所以v(X)=$\frac{\frac{0.04}{1.0}}{{t}_{1}}$mol/(L•min)$\frac{0.04}{{t}_{1}}$mol/(L•min),故A正确;
B.设反应的X物质的量为x,
X(g)?Y(g)+Z(g)
起始量(mol) 0.10 0 0
转化量(mol) x x x
平衡量(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,有$\frac{0.10-x+x+x}{0.1}$=$\frac{0.9}{0.5}$,解得:x=0.08,容器体积为1.0L,所以K=$\frac{0.08×0.08}{0.10-0.08}$=0.32,故B正确;
C.减少Z,生成物浓度减小,平衡向着正向移动;该反应为放热反应,降低温度后平衡向着正向移动,所以减少Z或降低温度都可以提高平衡体系中Y的含量,故C正确;
D.恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低,故D错误;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生的分析、理解能力及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol KClO3 参加反应有2mol电子转移 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | KClO3 在反应中得到电子,作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | pH=1的水溶液中:Al3+、NH4+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释溶液,水解平衡常数增大 | |
| B. | 升高温度,C(CO32-) 减小 | |
| C. | 稀释溶液,溶液中所有离子浓度均减小 | |
| D. | 加入NaOH(s),溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 | |
| B. | 光导纤维遇强碱会“断路” | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
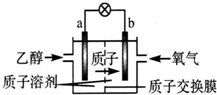 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )| A. | a极为电池的正极 | |
| B. | 电池正极的电极反应:4H++O2+4e-═2H2O | |
| C. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| D. | 设每个电子所带电量为q库仑,则1 mol乙醇被氧化产生12q库仑的电量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A浓度表示该反应速率为1.6 mol/(L•min) | |
| B. | 若使容器体积变为1 L,则B的物质的量一定减小 | |
| C. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| D. | 若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com