
【题目】在一密闭容器中发生反应:2X(g)+Y(g) ![]() aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
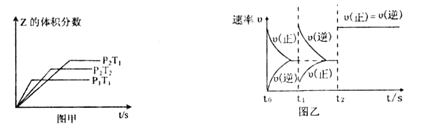
A.图甲,P1>P2,a < 3
B.图甲,T1<T2,Q >0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3, t2时表示向体系中加入了催化剂
【答案】C
【解析】
试题分析:A.由P1T1、P2T1可知,P1先达到平衡,则P1>P2,压强大,而Z的体积分数小,则加压平衡逆向移动,所以a>3,故A错误;B.由P2T1、P2T1可知,T2先达到平衡,则T1<T2,温度高,而Z的体积分数小,则升高温度,平衡逆向移动,所以Q<0,故B错误;C.图乙中t1时逆反应速率增大,正反应速率减小,则增大生成物浓度的同时减少反应物浓度,只加入Z,逆反应速率增大,恒压条件下,体积增大,反应为浓度减小,正反应速率减小,图象符合,故C正确;D.如果α=3,该反应为气体体积不变的反应,t2时正逆反应速率同等程度的增大,则t2时表示向体系中加入了催化剂或增大压强,故D错误;故选C。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示。若用HA表示酸,下列说法正确的是( )
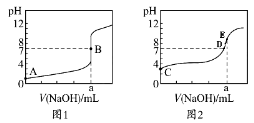
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当V(NaOH)=20.00 mL时,两混合溶液中各离子浓度由大到小的顺序均为c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.请回答:
(1)Na2O2的电子式 。
(2)除去FeCl3中少量FeCl2,除杂过程涉及的化学反应方程式 。
(3)往饱和Na2CO3溶液中通入CO2气体,溶液中出现白色浑浊,写出该反应的离子方程式 。
(4)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:
( )MnO4-+( )H2O2+ =( )Mn2++( )H2O+ 。
Ⅱ.无机化合物A 和NaH都是重要的还原剂,遇水都强烈反应。一定条件下,2.40g NaH与气体B反应生成3.90g化合物A和 2.24L(已折算成标准状况)的H2。已知气体B可使湿润红色石蕊试纸变蓝。已知:NH3+ NH3=NH4++NH2-
请回答下列问题:
(1)A的化学式是 。
(2)A与足量盐酸发生非氧化还原反应的化学方程式 。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
B.碳酸钙粉末加入醋酸溶液中:CaCO3+2H+=Ca2++CO2↑+H2O
C.Ca(OH)2溶液与过量NaHCO3溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D.电解饱和NaCl溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. SO2具有还原性,,可用于漂白纸浆
B. 碳酸氢钠能与碱反应,可用作食品的膨松剂
C. 四氯化碳密度比水大,可用于萃取溴水中的Br2
D. MgO、Al2O3的熔点都很高,都可用作耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
A. c(HCOO-)>c(Na+) B. c(HCOO-)<c(Na+)
C. c(HCOO-)=c(Na+) D. 无法确定c(HCOO-)与c(Na+)的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A.图甲表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态
B.图乙表示向0.1 mol·L–1的氨水溶液中逐渐加水时溶液的导电性变化
C.图丙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
D.图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
SO3(g)+NO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol ·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol ·L-1 | 0.10 | 0.10 | 0.20 |
A.平衡时,乙中SO2的转化率大于50%
B.当反应平衡时,丙中c(SO2)是甲中的2倍
C.温度升至90℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol ·L-1 NO2和0.20 mol ·L-1 SO2,达到平衡时c(NO)与原平衡不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为____________mol,放出的热量为____________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=____________。
(4)某氮肥厂氨氮废水中的氮元素多以NH![]() 和NH3·H2O形式存在,该废水的处理流程中,NH
和NH3·H2O形式存在,该废水的处理流程中,NH![]() 在微生物作用的条件下经过两步反应被氧化成NO
在微生物作用的条件下经过两步反应被氧化成NO![]() 。两步反应的能量变化示意如图所示:
。两步反应的能量变化示意如图所示:
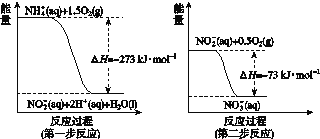
1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是________________。
(aq)的热化学方程式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com