
����Ŀ����ҵ��ˮ�г�����һ������Cr2O72-��CrO42-�����ǻ�����༰��̬ϵͳ�����ܴ�Σ����������д��������õĴ����������������֣�
����1����ԭ������
�÷��Ĺ�������Ϊ��
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
���еڢٲ�����ƽ��2CrO42-����ɫ��+2H+![]() Cr2O32-����ɫ��+H2O
Cr2O32-����ɫ��+H2O
(1)��ƽ����ϵ��pH=2������Һ��______ɫ��
(2)��˵���ڢٲ���Ӧ��ƽ��״̬����_____������ţ�
A��Cr2O72-��CrO42-��Ũ����ͬ
B��2v��Cr2O72-��=v��CrO42-��
C����Һ����ɫ����
(3)�ڢڲ��У���ԭ1mol Cr2O72-���ӣ���Ҫ______mol��FeSO4��7H2O��
(4)�ڢ۲����ɵ�Cr(OH)3����Һ�д������³����ܽ�ƽ�⣺Cr(OH)3(s) ![]() Cr3+(aq)+3OH(aq)�������£�Cr(OH)3���ܶȻ�Ksp=c(Cr3+)��c3(OH)=1032��Ҫʹc(Cr3+)����105mol/L����Һ��pHӦ����______��
Cr3+(aq)+3OH(aq)�������£�Cr(OH)3���ܶȻ�Ksp=c(Cr3+)��c3(OH)=1032��Ҫʹc(Cr3+)����105mol/L����Һ��pHӦ����______��
����2����ⷨ
�÷���Fe���缫��⺬Cr2O72-�����Է�ˮ�����ŵ��Ľ��У�������������ҺpH���ߣ�����Cr(OH)3������
(5)��Fe���缫��ԭ��Ϊ______���õ缫��Ӧʽ���ͣ���
(6)������������ҺpH���ߣ���Һ��ͬʱ���ɵij�������______��
���𰸡��� C 6 5 ������ӦΪFe2e=Fe2+���ṩ��ԭ��Fe2+ Fe(OH)3
��������
(1)��Һ�����ԣ�c(H+)�ϴ�����ƽ�����ƣ�����Һ�Գ�ɫ��
(2)A����Ӧ�����п��ܳ���Cr2O72-��CrO42-��Ũ����ͬ������Ӧ��һ���ﵽƽ��״̬��A����
B��2v��Cr2O72-��=v��CrO42-����û�б�����淴Ӧ���ʣ����ж���Ӧ�Ƿ�ﵽƽ��״̬��B����
C��ƽ��ʱ�����ʵ�Ũ�Ȳ��ٸı䣬����Һ����ɫ���ٸı䣬�����жϷ�Ӧ�ﵽƽ��״̬��C��ȷ����������ѡC��
(3)���ݵ��ӵ�ʧ�غ����֪������ԭ1mol Cr2O72-���ӵõ�Cr3+���õ����ӣ�2����6-3��=6mol��Fe2+������ΪFe3+����ҪFeSO4��7H2O�����ʵ���Ϊ![]() =6mol��
=6mol��
(4)��c(Cr3+)=105mol/Lʱ����Һ��c(OH)=![]() mol/L =109mol/L��c(H+)=
mol/L =109mol/L��c(H+)=![]() mol/L =105mol/L��pH=5����Ҫʹc(Cr3+)����105mol/L����Һ��pHӦ����5��
mol/L =105mol/L��pH=5����Ҫʹc(Cr3+)����105mol/L����Һ��pHӦ����5��
(5)��Fe������������������Ӧ��ʧ���ӣ�Fe2e=Fe2+��������������������ԭ����Cr2O72-��ԭ��Cr3+��
(6)��Һ���������������õ��ӱ���ԭΪ��������������ӦΪ��2H++2e=H2������Һ���Լ�������ҺpH���ߣ��������ӱ�����Ϊ�����ӣ����Լ����������Ӳ�������Fe(OH)3��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ʒ��ϩ(D)���������ϵ�ԭ�ϣ�������A�ϳɵõ�������ʾ������˵����ȷ���� (����)
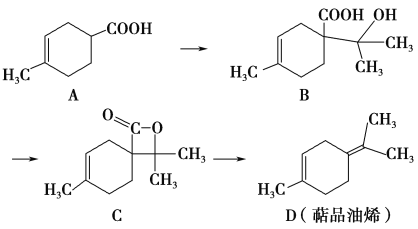
A. �л���B�ķ���ʽΪC11H19O3
B. �л���D����������̼ԭ��һ������
C. 1 mol�л���A�к���1.204��1024��˫��
D. �л���C��ͬ���칹���в������з��㻯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(C8H10)���������ϵ��屽��ϩ(C8H8)���䷴Ӧԭ���ǣ�C8H10(g)![]() C8H8(g)+H2(g)��H=120kJmol-1ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ����������������ʵ������õ��������±���
C8H8(g)+H2(g)��H=120kJmol-1ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ����������������ʵ������õ��������±���
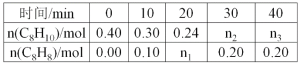
��1������Ӧ���е�20minʱ���ö�ʱ����H2��ƽ����Ӧ������__��
��2�����¶��£���Ӧ��ƽ�ⳣ������ʽ��K=____��K��ֵ��__��
��3�������������������䣬��0.50molH2(g)��0.50molC8H8(g)�ϳ�C8H10(g)������30kJ�����ų�ʱ���÷�Ӧ��H2��ת������__����ʱ���úϳɷ�Ӧ�Ƿ�ﵽ��ƽ��״̬��__����������������������������Ӧ����__�淴Ӧ���ʣ�����ڡ�С�ڻ���ڣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A.�������ܷų���������Һ��Na+��NO3-��Cl-��Ba2+
B.�μӼ����Ժ�ɫ����Һ��K+��NH4+��Cl-��SO42-
C.![]() =1013����Һ��Fe2+��Cl-��MnO4-��SO42-
=1013����Һ��Fe2+��Cl-��MnO4-��SO42-
D.ʹ��ɫʯ����ֽ����ɫ����Һ��Na+��ClO-��Cl-��S2-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��R�Ǻϳ�ij�߷��Ӳ��ϵĵ��壬��ṹ��ʽ��ͼ��ʾ������˵���������
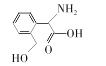
A.R��HOCH2COOH������������������ȫ��ͬ
B.��NaHCO3��Һ�ɼ���R���Ƿ����Ȼ�
C.R�ܷ����ӳɷ�Ӧ��ȡ����Ӧ
D.R�����ϵ�һ�������4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��Fe(OH)2��Cu(OH)2�ı�����Һ�У����������ӵ����ʵ���Ũ�ȵĸ�����[��lgc(M2+)]����ҺpH�ı仯��ϵ��ͼ��ʾ����֪���¶���Ksp[Cu(OH)2]��Ksp[Fe(OH)2]������˵����ȷ���ǣ� ��
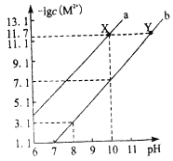
A.����b��ʾCu(OH)2������Һ�еı仯��ϵ
B.��ȥCuSO4��Һ�к��е�����Fe2+���ɼ�������CuO
C.��Fe(OH)2��Cu(OH)2��������ʱ����Һ��c(Fe2+)��c(Cu2+)��104.6��1
D.��X���Ӧ�ı�����Һ�м�������NaOH���壬��ת��ΪY���Ӧ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ִ�������Ϣ�����ڻ�ѧʵ�����й㷺��Ӧ�á�ijС���ô��м����ⶨ��Ȫʵ���е�ѹǿ�仯����ʶ��Ȫʵ���ԭ������ͼ1��ʾ�������ⶨ����ƽ�ⳣ��Kb��
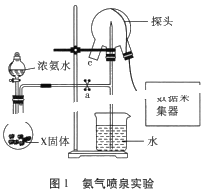
��1��ʵ���ҿ���Ũ��ˮ��X������ȡNH3��X���岻������___��
A������������ B����ʯ�� C����ʯ�� D����ˮ�Ȼ���
��2����������ƿ����NH3�ķ�����___��
��3���ر�a��������װ��ˮ�Ľ�ͷ�ιܵ���Ƥ������c�ڣ�___��������Ȫʵ�飬���Ի�������ƿ����ѹ�仯������ͼ2��ʾ��ͼ2��___��ʱ��Ȫ����ҡ�
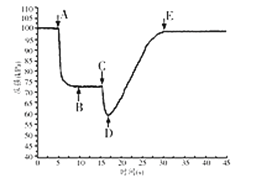
��4��������ƿ����___�����������ƣ���ȡ20.00mL��ˮ����ƿ�У���0.05000mol/LHC1�ζ�����pH�Ʋɼ����ݡ����Ի��Ƶζ�������ͼ3��ʾ��
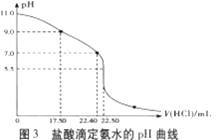
��5����ͼ3���㣬��pH=11.0ʱ��NH3��H2O����ƽ�ⳣ��Kb����ֵ��Kb��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����������ͨ��60 mLŨ��Ϊ10.00 mol/L���ȵ���������Ũ��Һ�У���Һ���γ�NaCl��NaClO��NaClO3������ϵ�������жϲ���ȷ����
A.��NaOH��Ӧ������һ��Ϊ0.3 mol
B.n(Na��)��n(Cl��) ����Ϊ7��3
C.����Ӧ��ת�Ƶĵ���Ϊn mol����0.3 n 0.5
D.n(NaCl)��n(NaClO)��n(NaClO3)����Ϊ11��1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ϩ����ͨ��1��3-����ϩ����ϩ���������ӳɷ�Ӧ�õ���
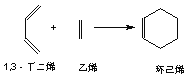
ʵ��֤�������з�Ӧ�У���Ӧ����ӵĻ���˫���Ȼ���˫�������ױ�������
![]()
![]()
![]()
�ֽ���1,3-����ϩΪ�л�ԭ�ϣ����Լ���ѡ��������;���ϳɼ������飺

(1)д���ṹ��ʽ�� A _____________��B ______________
(2)����������������黥Ϊͬϵ�����_____________
(3)1 mol A��1 mol HBr�ӳɿ��Եõ�___________�ֲ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com