
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+
B.滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42-
C.![]() =1013的溶液:Fe2+、Cl-、MnO4-、SO42-
=1013的溶液:Fe2+、Cl-、MnO4-、SO42-
D.使红色石蕊试纸变蓝色的溶液:Na+、ClO-、Cl-、S2-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
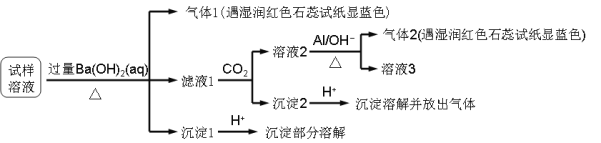
已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3 + 8AlO2-
3NH3 + 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是
试样中肯定存在NH4+、Mg2+、SO42-和NO3-
试样中一定不含Al3+
试样中可能存在Na+、Cl-
该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中含有少量杂质![]() 括号中是杂质
括号中是杂质![]() ,除杂方法正确的是
,除杂方法正确的是
A.乙醇![]() 乙酸
乙酸![]() :加入碳酸钠溶液,振荡,静置,分液
:加入碳酸钠溶液,振荡,静置,分液
B.硝基苯![]() 硫酸
硫酸![]() :将其加入NaOH溶液中,振荡,静置,分液
:将其加入NaOH溶液中,振荡,静置,分液
C.乙醛![]() 乙酸乙酯
乙酸乙酯![]() :加入氢氧化钠溶液,振荡,静置,分液
:加入氢氧化钠溶液,振荡,静置,分液
D.溴乙烷![]() 溴
溴![]() :加入四氯化碳,振荡,静置,分液
:加入四氯化碳,振荡,静置,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究新制饱和氯水成分的实验时,由实验现象得出的结论错误的是
A.氯水呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含Cl-
C.向氯水中滴加NaHCO3,有气泡产生,说明氯水中含有HCl和HClO
D.向FeCl2溶液中滴加氯水,溶液变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝有多种化合物,在工业上用途广泛。氮化铝(AlN)中混有碳和氧化铝,为确定某氮化铝样品的纯度,进行如下实验:(已知:AlN + H2O + NaOH→ NaAlO2 + NH3↑)
(1)称取5.00g样品,加入25mL5mol/L的NaOH溶液,共热,样品中AlN和Al2O3完全反应,测得放出氨气1.68L(标准状况)。该样品中的A1N的质量分数为___________。
(2)过滤上述混合溶液,向滤液中滴加2mol/L的盐酸,当滴至202mL时生成的白色沉淀恰好完全消失,5.00g样品中Al2O3的物质的量是多少摩________?(写出计算过程)
碱式碳酸铝镁[MgxAly(OH)a(CO3)b·nH2O]可做为塑料填料。为确定某碱式碳酸铝镁的组成,进行如下实验:
(3)称取3.390g样品与足量稀盐酸充分反应,生成二氧化碳0.560L(标准状况)。3.390g样品中含CO32―________g。
(4)另取100.00g样品在空气中加热,固体质量随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上固体为金属氧化物的混合物)。
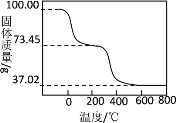
(i)100.00g样品中含结晶水_______mol。
(ii)100.00g样品中OH―的物质的量是多少_______?(写出计算过程)
(iii)通过计算推测该碱式碳酸铝镁的化学式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列有关物质的用途、性质都正确且有相关性的是
选项 | 用途 | 性质 |
A | 液氨作制冷剂 | NH3分解生成N2和H2的反应是吸热反应 |
B | NH4Fe(SO4)2·12H2O常作净水剂 | NH4Fe(SO4)2·12H2O具有氧化性 |
C | 漂粉精可以作环境消毒剂 | 漂粉精溶液中ClO-和HClO都有强氧化性 |
D | Al2O3常作耐高温材料 | Al2O3,既能与强酸反应,又能与强碱反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理。常用的处理方法有以下两种:
方法1:还原沉淀法
该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡2CrO42-(黄色)+2H+![]() Cr2O32-(橙色)+H2O
Cr2O32-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色。
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至______。
Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至______。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为______(用电极反应式解释)。
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 X中可能含有如下离子:Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
、Cl-。取一定量该溶液,加入过量的BaCl2溶液,充分反应后过滤得固体Y和滤液Z。下列说法正确的是
A.取溶液X进行焰色反应,火焰呈黄色。说明溶液不含K+
B.取固体Y加入过量的稀盐酸,沉淀部分溶解。说明溶液X含![]() 、不含
、不含![]()
C.取滤液Z加入足量HNO3后再加入AgNO3溶液,有白色沉淀生成。说明溶液X中含Cl-
D.取滤液Z加入NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝。说明溶液X中含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
A.阳极反应式相同
B.电解结束后所得液体的pH相同
C.阴极反应式相同
D.通过相同电量时生成的气体总体积相等(同温同压)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com