
【题目】铝有多种化合物,在工业上用途广泛。氮化铝(AlN)中混有碳和氧化铝,为确定某氮化铝样品的纯度,进行如下实验:(已知:AlN + H2O + NaOH→ NaAlO2 + NH3↑)
(1)称取5.00g样品,加入25mL5mol/L的NaOH溶液,共热,样品中AlN和Al2O3完全反应,测得放出氨气1.68L(标准状况)。该样品中的A1N的质量分数为___________。
(2)过滤上述混合溶液,向滤液中滴加2mol/L的盐酸,当滴至202mL时生成的白色沉淀恰好完全消失,5.00g样品中Al2O3的物质的量是多少摩________?(写出计算过程)
碱式碳酸铝镁[MgxAly(OH)a(CO3)b·nH2O]可做为塑料填料。为确定某碱式碳酸铝镁的组成,进行如下实验:
(3)称取3.390g样品与足量稀盐酸充分反应,生成二氧化碳0.560L(标准状况)。3.390g样品中含CO32―________g。
(4)另取100.00g样品在空气中加热,固体质量随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上固体为金属氧化物的混合物)。
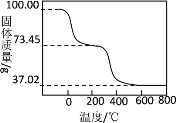
(i)100.00g样品中含结晶水_______mol。
(ii)100.00g样品中OH―的物质的量是多少_______?(写出计算过程)
(iii)通过计算推测该碱式碳酸铝镁的化学式_______。
【答案】0.615 0.009mol 1.5 1.475 0.4424mol Mg5Al (OH) 3(CO3)510H2O
【解析】
(1)由题意可知,AlN和Al2O3均能和NaOH反应,但是,只有AlN和NaOH反应放出NH3![]() ,据此计算;
,据此计算;
(2)滤液中加盐酸,先产生沉淀,继续滴加盐酸,沉淀逐渐溶解,发生的两个反应:HCl+NaOH=NaCl+H2O,NaAlO2+4HCl=AlCl3+2H2O+NaCl,NaOH为(1)中未反应的部分,此时溶液中溶质有两种:AlCl3和NaCl,根据原子守恒进行计算;
(3) 二氧化碳来源于碳酸根离子,根据C原子守恒计算n(CO32-),根据m=nM计算碳酸根离子质量;
(4)(i)样品在270℃时已完全失去结晶水,结晶水的质量=(100.00-73.45)g=26.55g,根据n=![]() 计算水的物质的量;
计算水的物质的量;
(ii)100.00g样品在270~600℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O,m(CO2)+m(H2O)=73.45-37.02=36.43g,根据质量分数不变计算100.00g该物质分解生成二氧化碳质量,从而计算氢氧根离子生成水的质量,从而计算氢氧根离子的物质的量;
(iii)根据电荷守恒、质量守恒计算x、y,从而确定化学式。
(1)AlN + H2O + NaOH→ NaAlO2 + NH3↑,该反应产生NH3的物质的量=![]() ,
,
AlN + H2O + NaOH→ NaAlO2 + NH3↑
0.075mol 0.075mol
所以AlN的质量=0.075mol![]() 41g·mol-1=3.075g,所以AlN的质量分数=
41g·mol-1=3.075g,所以AlN的质量分数=![]() ;故答案为:0.615;
;故答案为:0.615;
(2)向滤液中滴加2mol/L的盐酸,当滴至202mL时生成的白色沉淀恰好完全消失,溶液中溶质有两种:AlCl3和NaCl,设AlCl3的物质的量为x,NaCl的物质的量为y,根据Na原子守恒可知:y=5mol/L×25ml×10-3=0.125mol,由Cl守恒可知:3x+y=2mol/L×202×10-3L=0.404mol,解得x=0.093mol,所以此时溶液中有0.093molAlCl3,因为AlN物质的量=0.075mol,根据Al守恒可得n(Al2O3)=![]() 0.009mol,故答案为:0.009mol;
0.009mol,故答案为:0.009mol;
(3) n(CO2)=![]() =0.025mol,二氧化碳来源于碳酸根离子,根据C原子守恒得n(CO32-)=n(CO2)=0.025mol,则m(CO32-)=nM=0.025mol×60g/mol=1.5g,故答案为:1.5;
=0.025mol,二氧化碳来源于碳酸根离子,根据C原子守恒得n(CO32-)=n(CO2)=0.025mol,则m(CO32-)=nM=0.025mol×60g/mol=1.5g,故答案为:1.5;
(2)①样品在270℃时已完全失去结晶水,结晶水的质量=(100.00-73.45)g=26.55g,n(H2O)=![]() =
=![]() =1.475mol,故答案为:1.475;
=1.475mol,故答案为:1.475;
②100.00g样品在270~600℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O,m(CO2)+m(H2O)=73.45-37.02=36.43g,其中n(CO2)=0.56L/22.4mol/L=0.025mol;m(CO2)=![]() =32.45g,m(H2O)=36.43-32.45=3.98g,n(H2O)=
=32.45g,m(H2O)=36.43-32.45=3.98g,n(H2O)=![]() =0.2212mol,根据H原子守恒得n(OH-)=2n(H2O)=0.4424mol,故答案为;0.4424mol;
=0.2212mol,根据H原子守恒得n(OH-)=2n(H2O)=0.4424mol,故答案为;0.4424mol;
③根据电荷守恒得2x+3y=0.4424×1+2×![]() ……I,根据质量守恒得40x+0.5×102y=37.02……II,联合I、II得x=0.7374mol、y=0.1476mol,x:y:a:b:n=0.7374mol:0.1476mol:0.444mol:0.7374mol:
……I,根据质量守恒得40x+0.5×102y=37.02……II,联合I、II得x=0.7374mol、y=0.1476mol,x:y:a:b:n=0.7374mol:0.1476mol:0.444mol:0.7374mol:![]() :1.475mol=5:1:3:5:10,所以其化学式为Mg5Al (OH) 3(CO3)510H2O,故答案为:Mg5Al (OH)3(CO3)510H2O。
:1.475mol=5:1:3:5:10,所以其化学式为Mg5Al (OH) 3(CO3)510H2O,故答案为:Mg5Al (OH)3(CO3)510H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】阿斯巴甜(结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍。下列有关说法不正确的是

A. 分子式为:C14H18N2O5
B. 阿斯巴甜分子中有3种官能团
C. 阿斯巴甜在一定条件下既能与酸反应、又能与碱反应
D. 阿斯巴甜的水解产物中有两种氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.2SO2+O2=2SO3;△H=-196.6kJ·mol-1
B.C(s)+O2(g)=CO2(g);△H=393.5kJ·mol-1
C.H+(aq)+OH-(aq)=H2O(l);△H=57.3kJ·mol-1
D.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H=-92.5kJ·mol-1
Cl2(g)=HCl(g);△H=-92.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)![]() C8H8(g)+H2(g)△H=120kJmol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
C8H8(g)+H2(g)△H=120kJmol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
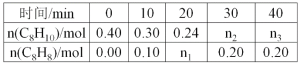
(1)当反应进行到20min时,该段时间内H2的平均反应速率是__。
(2)该温度下,反应的平衡常数表达式是K=____,K的值是__。
(3)若保持其他条件不变,用0.50molH2(g)和0.50molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__,此时,该合成反应是否达到了平衡状态?__(填“是”或“否”),且正反应速率__逆反应速率(填大于、小于或等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是
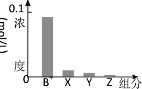
A.溶液显酸性
B.升温,c(X)增大,c(Y)减小
C.c(B+) + c(Y) = c(Cl-)
D.稀释溶液,c(X)增大,c(Z)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+
B.滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42-
C.![]() =1013的溶液:Fe2+、Cl-、MnO4-、SO42-
=1013的溶液:Fe2+、Cl-、MnO4-、SO42-
D.使红色石蕊试纸变蓝色的溶液:Na+、ClO-、Cl-、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R是合成某高分子材料的单体,其结构简式如图所示。下列说法错误的是
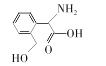
A.R与HOCH2COOH分子中所含官能团完全相同
B.用NaHCO3溶液可检验R中是否含有羧基
C.R能发生加成反应和取代反应
D.R苯环上的一溴代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(如图1所示),并测定电离平衡常数Kb。
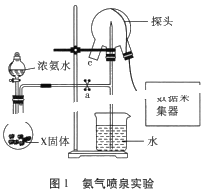
(1)实验室可用浓氨水和X固体制取NH3,X固体不可以是___;
A.五氧化二磷 B.生石灰 C.碱石灰 D.无水氯化钙
(2)检验三颈瓶集满NH3的方法是___。
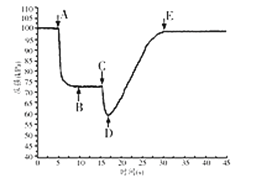
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口,___,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图2所示。图2中___点时喷泉最剧烈。
(4)从三颈瓶中用___(填仪器名称)量取20.00mL氨水至锥形瓶中,用0.05000mol/LHC1滴定。用pH计采集数据、电脑绘制滴定曲线如图3所示。
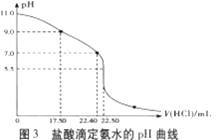
(5)据图3计算,当pH=11.0时,NH3·H2O电离平衡常数Kb近似值,Kb≈___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟道气中的 NO 是主要的大气污染物之一,为了监测其含量,选用如下检测方法:将vL气样通入适量酸化的 H2O2 溶液中,恰好使 NO 完全被氧化成NO3-,加水稀释至 100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗 v2mL。回答下列问题:
(1)NO被H2O2氧化为NO3-的离子方程式为:_____。
(2)滴定过程中发生下列反应:
3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NO的物质的量为_______mol。
(3)下列操作会使 NO 测定结果偏高的是_____
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4 标准溶液部分变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com