
【题目】下列热化学方程式书写正确的是( )
A.2SO2+O2=2SO3;△H=-196.6kJ·mol-1
B.C(s)+O2(g)=CO2(g);△H=393.5kJ·mol-1
C.H+(aq)+OH-(aq)=H2O(l);△H=57.3kJ·mol-1
D.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H=-92.5kJ·mol-1
Cl2(g)=HCl(g);△H=-92.5kJ·mol-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】“苏丹红一号”(结构如下图所示)是一种合成染料,科学家通过经毒理学研究,发现长期食用含有苏丹红的食品对人体可能有致癌因素。下列关于“苏丹红一号”的说法中不正确的是

A. 属于芳香族化合物,分子式为C16H12N2O
B. 分子中的所有原子可能位于同一平面上
C. 分子中苯环上的一取代物共有11种
D. 能与NaOH溶液、FeCl3溶液、溴水等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种有机物:①乙烯 ②2-丙醇 ③ 甲苯 ④ 乙炔,其中:
(1)能发生消去反应的是_________(填序号,下同),其化学方程式是________。
(2)能衡量一个国家的石油化工生产水平的是__________,该物质可用于一种常用塑料,其反应的化学方程式是__________。
(3)能用来制取梯恩梯(TNT)的是________,其发生反应的化学方程式是________。
(4)碳元素的质量百分含量最高的是________,实验室制取该物质的反应装置如下:
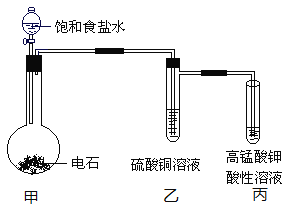
甲中反应的化学方程式是________,滴加饱和食盐水而不直接滴加水的原因是________,乙中硫酸铜溶液的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喝茶,对很多人来说是人生的一大快乐,茶叶中含有少量的咖啡因。咖啡因具有扩张血管、刺激心脑等作用,在100 ℃时失去结晶水并开始升华,120 ℃时升华相当显著,178 ℃时升华很快。结构简式如下:
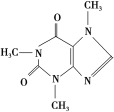
实验室可通过下列简单方法从茶叶中提取咖啡因:

(1)咖啡因的分子式为_____________。
(2)步骤1浸泡茶叶所用的溶剂最好为________。
A.水 B.酒精 C.石油醚
(3)步骤1、步骤4所进行的操作或方法分别是________,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和铜合金广泛用于电气、机械制造、建筑工业、国防工业等领域。
(1)以含Cu2S80%的精辉铜矿为原料冶炼金属铜(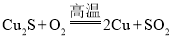 )。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
)。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
(2)高温时,Cu2S和O2在密闭容器中实际发生的反应为以下两步:
2Cu2S+3O2![]() 2Cu2O+ 2SO2、2Cu2O+ Cu2S
2Cu2O+ 2SO2、2Cu2O+ Cu2S![]() 6Cu+ SO2↑
6Cu+ SO2↑
取amol Cu2S和bmol空气(设氧气占空气体积的20%)在高温下充分反应。根据下列几种情况回答问题(反应前后温度、容器体积不变):
①若反应后剩余固体只有Cu,则a和b的关系是___________。
②若反应后剩余固体是Cu2S和Cu,则反应前容器内压强(P1)与反应后容器内压强(P2)的关系是_______。
③若反应后容器内的压强小于反应前,通过分析,确定反应前后容器内固体的成分___________。
(3)可用纯度为80%的精辉铜矿制备胆矾。称取8.0g矿样,溶解在40mL14.0mol/L的浓硝酸中(杂质不反应),反应为: 2Cu2S+14H++10NO3-→4Cu2++2SO42-+5NO↑+5NO2↑+7H2O。过滤后向所得溶液再加入适量的铜和稀硫酸,充分反应前后,将该溶液蒸发结晶。计算理论上最多可得到CuSO4·5H2O晶体多少克_______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中含有少量杂质![]() 括号中是杂质
括号中是杂质![]() ,除杂方法正确的是
,除杂方法正确的是
A.乙醇![]() 乙酸
乙酸![]() :加入碳酸钠溶液,振荡,静置,分液
:加入碳酸钠溶液,振荡,静置,分液
B.硝基苯![]() 硫酸
硫酸![]() :将其加入NaOH溶液中,振荡,静置,分液
:将其加入NaOH溶液中,振荡,静置,分液
C.乙醛![]() 乙酸乙酯
乙酸乙酯![]() :加入氢氧化钠溶液,振荡,静置,分液
:加入氢氧化钠溶液,振荡,静置,分液
D.溴乙烷![]() 溴
溴![]() :加入四氯化碳,振荡,静置,分液
:加入四氯化碳,振荡,静置,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝有多种化合物,在工业上用途广泛。氮化铝(AlN)中混有碳和氧化铝,为确定某氮化铝样品的纯度,进行如下实验:(已知:AlN + H2O + NaOH→ NaAlO2 + NH3↑)
(1)称取5.00g样品,加入25mL5mol/L的NaOH溶液,共热,样品中AlN和Al2O3完全反应,测得放出氨气1.68L(标准状况)。该样品中的A1N的质量分数为___________。
(2)过滤上述混合溶液,向滤液中滴加2mol/L的盐酸,当滴至202mL时生成的白色沉淀恰好完全消失,5.00g样品中Al2O3的物质的量是多少摩________?(写出计算过程)
碱式碳酸铝镁[MgxAly(OH)a(CO3)b·nH2O]可做为塑料填料。为确定某碱式碳酸铝镁的组成,进行如下实验:
(3)称取3.390g样品与足量稀盐酸充分反应,生成二氧化碳0.560L(标准状况)。3.390g样品中含CO32―________g。
(4)另取100.00g样品在空气中加热,固体质量随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上固体为金属氧化物的混合物)。
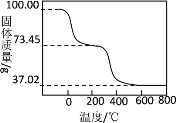
(i)100.00g样品中含结晶水_______mol。
(ii)100.00g样品中OH―的物质的量是多少_______?(写出计算过程)
(iii)通过计算推测该碱式碳酸铝镁的化学式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芥子醇是一种合成工程纤维的单体,结构简式如图。有关芥子醇的说法中正确的是
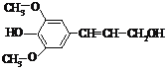
A.能与3 mol NaOH溶液反应
B.能通过与浓溴水的反应证明存在酚羟基
C.能发生的反应类型有氧化、取代、加成
D.能与钠反应、不能与碳酸钠和碳酸氢钠反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com