
【题目】下列有机物中含有少量杂质![]() 括号中是杂质
括号中是杂质![]() ,除杂方法正确的是
,除杂方法正确的是
A.乙醇![]() 乙酸
乙酸![]() :加入碳酸钠溶液,振荡,静置,分液
:加入碳酸钠溶液,振荡,静置,分液
B.硝基苯![]() 硫酸
硫酸![]() :将其加入NaOH溶液中,振荡,静置,分液
:将其加入NaOH溶液中,振荡,静置,分液
C.乙醛![]() 乙酸乙酯
乙酸乙酯![]() :加入氢氧化钠溶液,振荡,静置,分液
:加入氢氧化钠溶液,振荡,静置,分液
D.溴乙烷![]() 溴
溴![]() :加入四氯化碳,振荡,静置,分液
:加入四氯化碳,振荡,静置,分液
科目:高中化学 来源: 题型:
【题目】一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)![]() 2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。叙述正确的是( )
2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。叙述正确的是( )

A.温度T℃时,该反应的平衡常数K=![]()
B.温度T℃时,混合气体的密度不变即达到平衡状态
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b改变的条件是温度,则该正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量的混合气体发生反应xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
A.B的转化率降低B.平衡向正反应方向移动
C.x+y<zD.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定。滴定结果如下所示:
NaOH溶液起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 19.00mL |
(1)准确配制0.2000mol·L-1的氢氧化钠溶液250mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的玻璃仪器有___。
(2)根据以上数据可以计算出盐酸的物质的量浓度为___ mol·L-1。(保留4位有效数字)
(3)用0.2000mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视___,直到滴定终点。
(4)达到滴定终点的标志是___。
(5)以下操作造成测定结果偏高的原因可能是___ (填字母代号)。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其他操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)是反应活性很高的化学物质,常用于漂白,也用于清洗小的伤口。细胞在代谢过程中,也会产生H2O2,它对细胞有毒害作用,但体内有酶的存在可以使其分解为无毒物质。请分析下列一组实验,并回答有关问题。(试管内都为10 mL3%H2O2 ,原溶液温度都为37℃,从左到右试管依次编号为(1)~(5)。
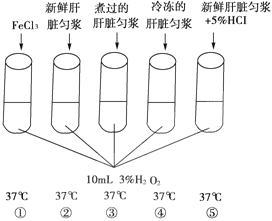
(1)在图(1)~(5)号试管中,最先产生气泡的是_____号试管;产生气泡最快的是______号试管;请写出该试管内所发生化学反应的反应式_______________。
(2)用点燃但无火焰的卫生香放到(1)~(5)号试管管口,能观察到__________现象。
(3)如果在(2)号试中收集到的有关气体为500 mL(S.T.P),那么需要3%H2O2溶液______________克。
(4)比较(1)~(5)号试管所看到的不同现象,说明了什么?__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )

A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1.00mol NaCl中含有6.02×1023个NaCl分子
B. 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C. 欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D. 电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定体积的密闭容器中,可逆反应,nA(g)+mB(g)![]() pC(g)已经达到平衡状态。已知n+m>p,ΔH<0。下列分析结论中正确的是( )
pC(g)已经达到平衡状态。已知n+m>p,ΔH<0。下列分析结论中正确的是( )
①升温,![]() 的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;⑤加压使密闭容器的容积变小,A或B的浓度则变大;⑥若A的反应速率为v(A),则v(B)=
的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;⑤加压使密闭容器的容积变小,A或B的浓度则变大;⑥若A的反应速率为v(A),则v(B)=![]() v(A)
v(A)
A.①②B.②③④C.③④⑤D.③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com