
【题目】在密闭容器中一定量的混合气体发生反应xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
A.B的转化率降低B.平衡向正反应方向移动
C.x+y<zD.C的体积分数增大
【答案】A
【解析】
反应xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,A的浓度为0.25mol/L,而再达平衡时,测得A的浓度为0.30mol/L,则说明体积增大(压强减小)化学平衡逆向移动,以此来解答。
zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,A的浓度为0.25mol/L,而再达平衡时,测得A的浓度为0.30mol/L,则说明体积增大(压强减小)化学平衡逆向移动,以此来解答。
由信息可知,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时测得A的浓度为0.30mol/L,体积增大,相当于压强减小,化学平衡逆向移动,则
A.减小压强,化学平衡逆向移动,则反应物B的转化率降低,A正确;
B.由上述分析可知,平衡逆向移动,B错误;
C.减小压强,化学平衡向气体体积增大的方向移动,则x+y>z,C错误;
D.减小压强,化学平衡逆向移动,则生成物C的体积分数减小,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H<0.改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
①升高温度________;
②加入催化剂________;
③充入更多的H2________;
④保持容器中压强不变,充入氖气________;
⑤保持容器容积不变,通入氖气________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是

A. 水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸.下列离子方程式可能与事实相符的是
A.OH﹣+2CO32﹣+3H+→2HCO3﹣+H2O
B.2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
C.2OH﹣+CO32﹣+4H+→CO2↑+3H2O
D.OH﹣+CO32﹣+3H+→CO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烯烃为原料,合成某些高聚物的路线如图:
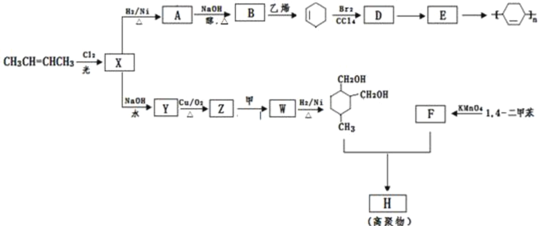
已知:Ⅰ.![]() (或写成
(或写成![]() R代表取代基或氢)
R代表取代基或氢)
Ⅱ.甲为烃
Ⅲ.F能与NaHCO3反应产生CO2请完成以下问题:
(1)CH3CH=CHCH3的名称是______,Br2的CCl4溶液呈______色.
(2)X→Y的反应类型为:______;D→E的反应类型为:______.
(3)H的结构简式是______.
(4)写出下列化学方程式:
A→B______;
Z→W______.
(5)化工生产表明高聚物H的产率不及设计预期,产率不高的原因可能是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据在相同的温度下NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小的性质,运用CO2+NH3+H2O+NaCl→NaHCO3↓+NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
![]()
则下列叙述正确的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是难溶于水的
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____。已知:K(300℃)>K(350℃),则该反应正反应是_________热反应。升高温度,正反应速率_______(填“增大”、“减小”或“不变”)。
(2)下图中表示NO2的变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v(O2)=______。
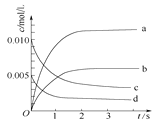
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中含有少量杂质![]() 括号中是杂质
括号中是杂质![]() ,除杂方法正确的是
,除杂方法正确的是
A.乙醇![]() 乙酸
乙酸![]() :加入碳酸钠溶液,振荡,静置,分液
:加入碳酸钠溶液,振荡,静置,分液
B.硝基苯![]() 硫酸
硫酸![]() :将其加入NaOH溶液中,振荡,静置,分液
:将其加入NaOH溶液中,振荡,静置,分液
C.乙醛![]() 乙酸乙酯
乙酸乙酯![]() :加入氢氧化钠溶液,振荡,静置,分液
:加入氢氧化钠溶液,振荡,静置,分液
D.溴乙烷![]() 溴
溴![]() :加入四氯化碳,振荡,静置,分液
:加入四氯化碳,振荡,静置,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时有三瓶溶液: pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
A.中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积
B.往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全
C.将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-)
D.25℃时pH=3的盐酸、pH=11的NaOH溶液中水电离出的c(H+)均为10-11 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com