
【题目】我国化学家侯德榜根据在相同的温度下NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小的性质,运用CO2+NH3+H2O+NaCl→NaHCO3↓+NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:
![]()
则下列叙述正确的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是难溶于水的
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
科目:高中化学 来源: 题型:
【题目】把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2 min内,用X表示的平均反应速率________;
(2)2 min末时Y的转化率________;
(3)化学方程式中Z的化学计量数n________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
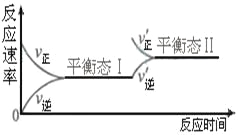
A. 反应达平衡时,正反应速率和逆反应速率相等
B. 该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C. 该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D. 同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量的混合气体发生反应xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50 mol/L。保持温度不变.将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是
A.B的转化率降低B.平衡向正反应方向移动
C.x+y<zD.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的二份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克。下列说法正确的是( )
A.该溶液中不一定含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+)≥0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定。滴定结果如下所示:
NaOH溶液起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 19.00mL |
(1)准确配制0.2000mol·L-1的氢氧化钠溶液250mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的玻璃仪器有___。
(2)根据以上数据可以计算出盐酸的物质的量浓度为___ mol·L-1。(保留4位有效数字)
(3)用0.2000mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视___,直到滴定终点。
(4)达到滴定终点的标志是___。
(5)以下操作造成测定结果偏高的原因可能是___ (填字母代号)。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其他操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )

A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com