
【题目】铜和铜合金广泛用于电气、机械制造、建筑工业、国防工业等领域。
(1)以含Cu2S80%的精辉铜矿为原料冶炼金属铜(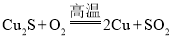 )。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
)。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
(2)高温时,Cu2S和O2在密闭容器中实际发生的反应为以下两步:
2Cu2S+3O2![]() 2Cu2O+ 2SO2、2Cu2O+ Cu2S
2Cu2O+ 2SO2、2Cu2O+ Cu2S![]() 6Cu+ SO2↑
6Cu+ SO2↑
取amol Cu2S和bmol空气(设氧气占空气体积的20%)在高温下充分反应。根据下列几种情况回答问题(反应前后温度、容器体积不变):
①若反应后剩余固体只有Cu,则a和b的关系是___________。
②若反应后剩余固体是Cu2S和Cu,则反应前容器内压强(P1)与反应后容器内压强(P2)的关系是_______。
③若反应后容器内的压强小于反应前,通过分析,确定反应前后容器内固体的成分___________。
(3)可用纯度为80%的精辉铜矿制备胆矾。称取8.0g矿样,溶解在40mL14.0mol/L的浓硝酸中(杂质不反应),反应为: 2Cu2S+14H++10NO3-→4Cu2++2SO42-+5NO↑+5NO2↑+7H2O。过滤后向所得溶液再加入适量的铜和稀硫酸,充分反应前后,将该溶液蒸发结晶。计算理论上最多可得到CuSO4·5H2O晶体多少克_______?
【答案】8.19×106 L 73.1t b=5a P1=P2 Cu2O、Cu和Cu2O 155
【解析】
(1)设日均产SO2标准状况下体积为y,根据元素守恒:
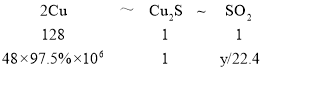
所以48×97.5%×106:![]() =128:1
=128:1
解得y=8.19×106
设需精辉铜矿的质量为x,根据元素守恒:

所以x80%:48×97.5%×106=160:128
解得x=73.1×106=73.1t
(2)①反应后固体全部是Cu时,则:2Cu2S+3O2![]() 2Cu2O+2SO2、2Cu2O+Cu2S
2Cu2O+2SO2、2Cu2O+Cu2S![]() 6Cu+ SO2↑,两方程式相加得:
6Cu+ SO2↑,两方程式相加得:
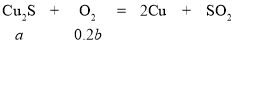
解得b=5a
故答案为:b=5a;
②Cu2S+O2=2Cu+SO2,反应后固体为Cu2S、Cu时,氧气不足,但反应前后气体的体积未变,所以P1=P2,
故答案为:P1=P2;
③2Cu2S+3O2=2Cu2O+2SO2,消耗3mol氧气生成2mol二氧化硫,当产物为Cu2O时,反应后容器内的压强小于反应前,Cu2S+O2=2Cu+SO2,反应后固体为Cu时,反应前后气体的体积未变,P1=P2,但反应后固体为Cu2O、Cu时,反应后容器内的压强小于反应前,所以反应后容器内的压强小于反应前,反应前为Cu2S,反应后容器内固体的成分为Cu2O或Cu和Cu2O,
故答案为:Cu2O或Cu和Cu2O;
(3)纯度为80%的精辉铜矿8.0g矿样,含铜n(Cu)=![]() ×2=0.08mol,可生成n(CuSO45H2O)=0.08mol,矿样溶解在40mL14.0mol/L的浓硝酸中(杂质不反应),2Cu2S+14H++10NO3-=4Cu2++2SO42-+5NO↑+5NO2↑+7H2O消耗硝酸n(HNO3)=
×2=0.08mol,可生成n(CuSO45H2O)=0.08mol,矿样溶解在40mL14.0mol/L的浓硝酸中(杂质不反应),2Cu2S+14H++10NO3-=4Cu2++2SO42-+5NO↑+5NO2↑+7H2O消耗硝酸n(HNO3)=![]() ×
×![]()
=0.2mol,过滤后向所得溶液再加入适量的铜和稀硫酸,相当于铜溶解在稀硝酸中,然后全部转化为硫酸铜晶体,n(HNO3)=(0.56-0.2)mol=0.36mol,2NO3-+3Cu+8H+=3Cu2++2NO↑+4H2O,溶解铜n(Cu)=![]() ×3=0.54mol,则消耗的铜的总的物质的量为n(Cu)=0.54mol+0.08mol=0.62mol,根据铜原子守恒,理论上最多可得到CuSO45H2O晶体m(CuSO45H2O)=n×M=0.62mol×250g/mol=155g,
×3=0.54mol,则消耗的铜的总的物质的量为n(Cu)=0.54mol+0.08mol=0.62mol,根据铜原子守恒,理论上最多可得到CuSO45H2O晶体m(CuSO45H2O)=n×M=0.62mol×250g/mol=155g,
故答案为:155。


科目:高中化学 来源: 题型:
【题目】某种有机化合物的结构简式如图所示。有关该物质的说法中正确的是( )
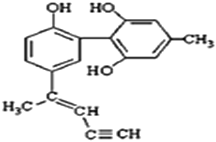
A.该物质有四种官能团,其中一种名称为羟基
B.该分子中的所有碳原子不可能共平面
C.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
D.1 mol该物质与H2反应时最多消耗H2 9 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放入28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入粉末质量/g | 13.68 | 27.36 | 34.20 |
生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
完成下列各题:
(1)实验②所得溶液中的溶质是_______(写化学式),样品中n(Fe)∶n(Fe3O4)=________,m=____________。
(2)计算实验③中每份硝酸溶液的体积(V)(mL)_________。
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图:
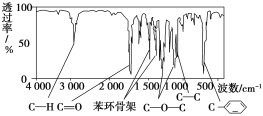
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的分子式为________。
(2)A的结构简式为_______________________________________________(写一种即可)。
(3)A的芳香化合物类同分异构体有多种,其中分子中不含甲基的芳香酸为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4,暗紫色固体),是一种新型、高效、多功能的水处理剂。完成下列填空:
(1)K2FeO4溶于水得到浅紫红色的溶液,且易水解,生成氧气和氢氧化铁。写出该水解反应的离子方程式_________;说明高铁酸钾做水处理剂的原理______。
(2)下图分别是1mol/L的K2FeO4溶液在不同pH和温度下c(FeO42-)随时间的变化曲线。
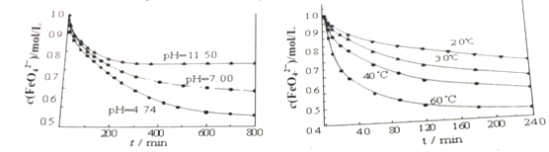
根据以上两图,说明配制K2FeO4溶液的注意事项______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.2SO2+O2=2SO3;△H=-196.6kJ·mol-1
B.C(s)+O2(g)=CO2(g);△H=393.5kJ·mol-1
C.H+(aq)+OH-(aq)=H2O(l);△H=57.3kJ·mol-1
D.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H=-92.5kJ·mol-1
Cl2(g)=HCl(g);△H=-92.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.2mol/L的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是
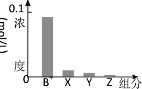
A.溶液显酸性
B.升温,c(X)增大,c(Y)减小
C.c(B+) + c(Y) = c(Cl-)
D.稀释溶液,c(X)增大,c(Z)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般硫粉含有S(单斜)和S(正交)两种同素异形体。已知常温下:
S(S,单斜)+O2(g)![]() SO2(g)+297.16 kJ;
SO2(g)+297.16 kJ;
S(S,正交)+O2(g)![]() SO2(g)+296.83 kJ
SO2(g)+296.83 kJ
下列说法正确的是
A.S(g)+O2(g)![]() SO2(g)+Q3 Q3>297.16 kJ
SO2(g)+Q3 Q3>297.16 kJ
B.单斜硫和正交硫互为同分异构体
C.常温下单斜硫比正交硫稳定
D.单斜硫转化为正交硫的反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com