
【题目】高铁酸钾(K2FeO4,暗紫色固体),是一种新型、高效、多功能的水处理剂。完成下列填空:
(1)K2FeO4溶于水得到浅紫红色的溶液,且易水解,生成氧气和氢氧化铁。写出该水解反应的离子方程式_________;说明高铁酸钾做水处理剂的原理______。
(2)下图分别是1mol/L的K2FeO4溶液在不同pH和温度下c(FeO42-)随时间的变化曲线。
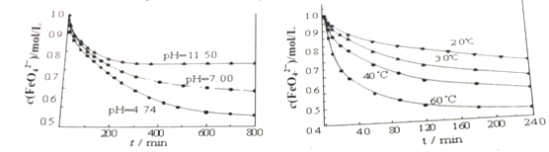
根据以上两图,说明配制K2FeO4溶液的注意事项______________。
【答案】4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑ 强氧化性;杀菌消毒 低温、碱性条件下配制溶液
4Fe(OH)3+8OH-+3O2↑ 强氧化性;杀菌消毒 低温、碱性条件下配制溶液
【解析】
(1)用2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式为:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑;高铁酸根离子具有强氧化性,能杀菌消毒,氢氧化铁吸附水中的悬浮物,因此高铁酸钾可做水处理剂;
4Fe(OH)3+8OH-+3O2↑;高铁酸根离子具有强氧化性,能杀菌消毒,氢氧化铁吸附水中的悬浮物,因此高铁酸钾可做水处理剂;
(2)高铁酸根离子水解方程式:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑,依据图中数据可知升高温度,减小pH值,高铁酸根离子浓度降低,所以应在低温、碱性条件下配制高铁酸钾溶液。
4Fe(OH)3+8OH-+3O2↑,依据图中数据可知升高温度,减小pH值,高铁酸根离子浓度降低,所以应在低温、碱性条件下配制高铁酸钾溶液。


科目:高中化学 来源: 题型:
【题目】某恒温密闭容器中,可逆反应A(s)![]() B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于![]() 的分子结构,下列说法正确的是( )
的分子结构,下列说法正确的是( )
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 除苯环外的其余碳原子不可能都在一条直线上
C. 12个碳原子不可能都在同一平面上
D. 所有原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中溶液逐滴滴入②中,预测的现象与实际相符的是
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
|
A. | 稀盐酸 | 浓碳酸钠溶液 | 立即产生气泡 | |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 | |
C. | 氯化亚铁溶液 | 过氧化钠固体 | 产生气体和红褐色沉淀 | |
D. | 氢氧化钠溶液 | 氧化铝粉末 | 产生白色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
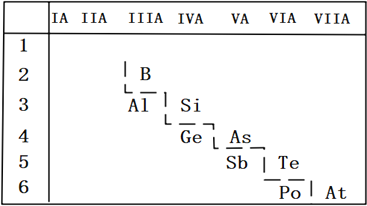
【题目】我国科学家受中医启发,发现As2O3(俗称砒霜)对白血病有疗效。氮、磷、砷(As)是VA族、第二至第四周期的元素,这些元素的化合物在研究和生产中有许多重要用途。
完成下列填空:
(1)As原子最外层电子的轨道表示式为_____________;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是__________。
(2)P的非金属性比As强,从原子结构的角度解释其原因_______;如图是元素周期表的一部分,请推测砷的单质或其化合物可能具有的性质_______________(写出两条即可)
(3)NH4NO3可做化肥,但易爆,300℃发生爆炸:2NH4NO3→2N2↑+O2↑+4H2O。每生成2molN2,反应中转移的电子为_____mol,氧化产物与还原产物的质量之比为_____。
(4)发电厂常用氨气吸收烟气中的CO2。常温下,当CO2不断通入pH=11的氨水中时会产生微量的新离子:NH2COO-。
(i)写出NH2COO-的电子式___________。
(ii)计算原氨水中c(NH4+)=_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和铜合金广泛用于电气、机械制造、建筑工业、国防工业等领域。
(1)以含Cu2S80%的精辉铜矿为原料冶炼金属铜(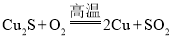 )。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
)。若生产含Cu量为97.5%的粗铜48t,则生产SO2_________L(标准状况下);需要精辉铜矿_______t(保留一位小数)。
(2)高温时,Cu2S和O2在密闭容器中实际发生的反应为以下两步:
2Cu2S+3O2![]() 2Cu2O+ 2SO2、2Cu2O+ Cu2S
2Cu2O+ 2SO2、2Cu2O+ Cu2S![]() 6Cu+ SO2↑
6Cu+ SO2↑
取amol Cu2S和bmol空气(设氧气占空气体积的20%)在高温下充分反应。根据下列几种情况回答问题(反应前后温度、容器体积不变):
①若反应后剩余固体只有Cu,则a和b的关系是___________。
②若反应后剩余固体是Cu2S和Cu,则反应前容器内压强(P1)与反应后容器内压强(P2)的关系是_______。
③若反应后容器内的压强小于反应前,通过分析,确定反应前后容器内固体的成分___________。
(3)可用纯度为80%的精辉铜矿制备胆矾。称取8.0g矿样,溶解在40mL14.0mol/L的浓硝酸中(杂质不反应),反应为: 2Cu2S+14H++10NO3-→4Cu2++2SO42-+5NO↑+5NO2↑+7H2O。过滤后向所得溶液再加入适量的铜和稀硫酸,充分反应前后,将该溶液蒸发结晶。计算理论上最多可得到CuSO4·5H2O晶体多少克_______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知燃烧7.8g乙炔气体生成CO2气体和液态水,放出390kJ的热量,则下列有关乙炔气体燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H═-390kJ·mol-1
B.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g) △H═-2600kJ·mol-1
C.C2H2(g)+2.5O2(g)═2CO2(g)+H2O(l) △H═-1300kJ·mol-1
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H═-1300kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数。下列叙述正确的是
A.1.2g金刚石中含有的碳碳单键数为0.4NA
B.300 mL 2 mol/L乙醇水溶液中所含H原子数为3.6NA
C.2.3 g钠在O2中充分反应得到3.5 g固体,转移电子数为0.15NA
D.标准状况下,22.4 L丙烯中含有碳氢键数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增加。甲、丙、戊是由这些元素组成的二元化合物。乙是元素W的单质,通常为黄绿色气体,丁的水溶液具有漂白性,0.01mol/L戊溶液的pH为2,己通常是难溶于水的混合物。上述物质的转化关系如图所示。回答下列问题:
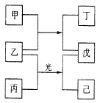
(1)写出化合物丁的结构式__。
(2)X、Z元素可形成原子个数比为1∶1的化合物,它的电子式为___。
(3)X、Y元素组成的某化合物分子中含18个电子。10g该化合物在空气充分燃烧生成稳定的氧化物放出的热量为QkJ,写出表示该物质燃烧热的热化学方程式___。
(4)Z、W两种元素组成的化合物WZ2的用途有___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com