
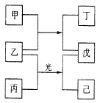
【题目】短周期元素X、Y、Z、W的原子序数依次增加。甲、丙、戊是由这些元素组成的二元化合物。乙是元素W的单质,通常为黄绿色气体,丁的水溶液具有漂白性,0.01mol/L戊溶液的pH为2,己通常是难溶于水的混合物。上述物质的转化关系如图所示。回答下列问题:
(1)写出化合物丁的结构式__。
(2)X、Z元素可形成原子个数比为1∶1的化合物,它的电子式为___。
(3)X、Y元素组成的某化合物分子中含18个电子。10g该化合物在空气充分燃烧生成稳定的氧化物放出的热量为QkJ,写出表示该物质燃烧热的热化学方程式___。
(4)Z、W两种元素组成的化合物WZ2的用途有___。
【答案】H—O—Cl ![]() C2H6(g)+
C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) ΔH=-3Q kJ·mol-1 杀菌消毒、漂白
O2(g)=2CO2(g)+3H2O(l) ΔH=-3Q kJ·mol-1 杀菌消毒、漂白
【解析】
短周期元素X、Y、Z、W的原子序数依次增加,甲、丙、戊是由这些元素组成的二元化合物。乙是黄绿色气体,故乙是Cl2,W是Cl;丁的水溶液具有漂白性,故丁含有ClO-,0.01mol/L戊溶液的pH为2,故戊是一元强酸,又因为反应物中含有Cl,所以戊是HCl,甲是H2O,丁是HClO;Cl2在光照条件下反应,故丙中含有C、H两种元素,所以X是H、Y是C、Z是O、W是Cl。
由上述分析可知,X是H、Y是C、Z是O、W是Cl:
(1)由上述分析可知,丁是HClO,HClO分子的中心原子是O原子,结构式是H—O—Cl;
(2)X是H、Z是O,X、Z元素可形成原子个数比为1∶1的化合物是H2O2,其电子式是
![]() ;
;
(3)X是H、Y是C,X、Y元素组成的化合物分子中含18个电子,该物质是C2H6,10g C2H6的物质的量是![]() =
=![]() ,因为10g C2H6在空气充分燃烧生成稳定的氧化物放出的热量为QkJ,故 1mol C2H6在空气充分燃烧生成稳定的氧化物放出的热量为3QkJ,C2H6燃烧热的热化学方程式为:C2H6(g)+
,因为10g C2H6在空气充分燃烧生成稳定的氧化物放出的热量为QkJ,故 1mol C2H6在空气充分燃烧生成稳定的氧化物放出的热量为3QkJ,C2H6燃烧热的热化学方程式为:C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) ΔH=-3Q kJ·mol-1;
O2(g)=2CO2(g)+3H2O(l) ΔH=-3Q kJ·mol-1;
(4)Z是O、W是Cl,Z、W两种元素组成的化合物WZ2是ClO2,ClO2的用途:杀菌消毒、漂白等。


科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4,暗紫色固体),是一种新型、高效、多功能的水处理剂。完成下列填空:
(1)K2FeO4溶于水得到浅紫红色的溶液,且易水解,生成氧气和氢氧化铁。写出该水解反应的离子方程式_________;说明高铁酸钾做水处理剂的原理______。
(2)下图分别是1mol/L的K2FeO4溶液在不同pH和温度下c(FeO42-)随时间的变化曲线。
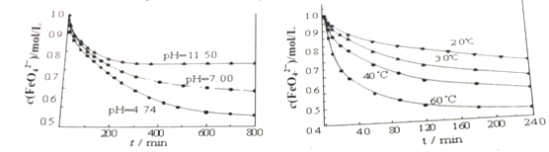
根据以上两图,说明配制K2FeO4溶液的注意事项______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下图所示的装置,模拟工业用含硫废水生产Na2S2O3·5H2O的过程。

锥形瓶C中发生反应:① Na2S+ H2O+SO2→ Na2SO3+ H2S② 2H2S+ SO2→ 3S↓+ 2 ③S+ Na2SO3![]() Na2S
Na2S
(1)若配制11.5mol/L的硫酸50 mL,需98.3%(密度1.84 g/cm3)的浓硫酸______mL,配制所需要的玻璃仪器有烧杯、玻璃棒、________。
(2)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若_______,则整个装置气密性良好。装置D的作用是______。装置E中为______溶液。
(3)装置B可用于观察SO2的生成速率,其中的液体最好选择__________。
a 饱和食盐水 b 饱和Na2SO3溶液
c 饱和NaHSO3溶液 d 饱和NaHCO3溶液
锥形瓶C的溶液中含有Na2S和过量的Na2SO3。已知反应③的速率是三个反应中最慢的,则锥形瓶C中反应达到终点的现象是_________。
(4)反应结束后,锥形瓶C的溶液中除含Na2S2O3,还可能含Na2SO3、Na2SO4等杂质。用所给试剂设计实验,检测锥形瓶C的溶液中是否存在Na2SO4(供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)简要说明实验操作,现象和结论:_____________。
(5)实验前锥形瓶C溶液中含有0.08molNa2S和0.04molNa2SO3,反应结束后经一系列操作,得到纯净的Na2S2O3·5H2O晶体19.11g,则Na2S2O3·5H2O产率是_______。(Na2S2O3·5H2O式量248)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=______________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________;
②该温度下,CO2的平衡转化率为________。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为_______。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________。(答出一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、硅及其化合物用途非常广泛。回答下列问题:
(1)基态Si原子价层电子的电子排布式为___,基态Mg原子电子占据最高能级的能层符号___。
(2)Mg2C3与CaC2的结构相似,与水反应可生成H2C=C=CH2,H2C=C=CH2端位碳原子的杂化方式是__,该反应所涉及的元素中电负性最小的是__(填元素符号),Mg2C3和H2C=C=CH2中均不存在___(填字母)。
A.σ键 B.配位键 C.氢键 D.π键
(3)晶格能又叫点阵能。它是1mol离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO晶格能可通过图1的BornHaber循环计算得到。
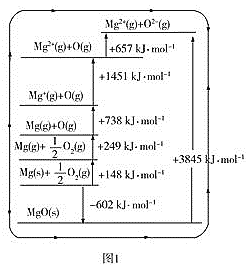
MgO的晶格能为___kJ·mol-1,O=O键的键能为__kJ·mol-1;Mg的第一电离能为___kJ·mol-1;
(4)Mg2Si晶胞结构如图2所示,已知其密度为1.84g·cm3,NA为阿伏加德罗常数的值。则晶胞参数a=__nm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般硫粉含有S(单斜)和S(正交)两种同素异形体。已知常温下:
S(S,单斜)+O2(g)![]() SO2(g)+297.16 kJ;
SO2(g)+297.16 kJ;
S(S,正交)+O2(g)![]() SO2(g)+296.83 kJ
SO2(g)+296.83 kJ
下列说法正确的是
A.S(g)+O2(g)![]() SO2(g)+Q3 Q3>297.16 kJ
SO2(g)+Q3 Q3>297.16 kJ
B.单斜硫和正交硫互为同分异构体
C.常温下单斜硫比正交硫稳定
D.单斜硫转化为正交硫的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )
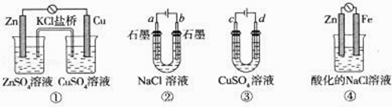
A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图装置进行“氨的催化氧化及检验产物”实验(图中夹持装置已略去)。下列推断合理的是( )
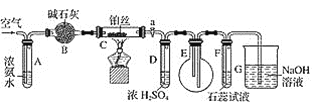
A.C不需要持续加热
B.D的作用是干燥气体
C.B是无用装置
D.仅用该套装置和药品无法达到检验产物的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是
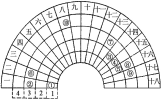
A.⑥、⑧、⑨对应原子的半径依次减小
B.②、⑦的最高价氧化物对应的水化物能相互反应
C.元素⑩为Fe元素,处于常见周期表第四周期第VIIIB族
D.①可分别与③、④、⑤均可形成既含极性键又含非极性键的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com