
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
【答案】A
【解析】
电解硝酸钾和硝酸铜混合溶液时,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电生成铜单质,当铜离子完全析出时,氢离子放电生成氢气,气体的物质的量为2.24L÷22.4L/mol=0.1mol;每生成0.1mol氧气转移0.4mol电子,每生成0.1mol氢气转移0.2mol电子,每生成1mol铜转移2mol电子,所以根据转移电子守恒得铜的物质的量=(0.4-0.2)/2mol=0.1mol,则铜离子的物质的量浓度为0.1mol÷0.5L=0.2mol/L,根据电荷守恒得钾离子浓度=0.6molL-1-0.2 molL-1×2=0.2mol/L。据此分析解答。
A、根据分析知,原混合溶液中c(K+)为0.2molL-1,正确;
B、转移电子的物质的量=0.1mol×4=0.4mol,错误;
C、根据以上分析知,铜的物质的量为0.1mol,错误;
D、当电解硝酸铜时溶液中生成氢离子,当电解硝酸钾溶液时,实际上是电解水,所以电解后氢离子的物质的量为氧气的4倍,为0.1mol×4=0.4mol,则氢离子浓度为0.8mol/L,错误;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
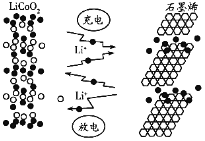
A. 充电时,![]() 嵌入
嵌入![]() 中
中
B. 放电时,![]() 极发生的电极反应为
极发生的电极反应为![]()
C. 放电时负极反应为:![]()
D. 充电时,若转移![]() ,石墨烯电极增重7g
,石墨烯电极增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)![]() C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】门捷列夫周期表是常见的经典形式,人们在研究前18号元素时发现,还可以将它们排成如图所示的“海螺”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )

A. A、B元素的简单离子半径比较A﹥B
B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素
D. A、B两种元素组成的化合物中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、W、Q的原子序数依次增。X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912。回答下列问题:
(1)基态Q原子的核外电子排布式是____________________。
(2)Q、W形成的化合物Q2W2中的化学键类型是______________。
(3)Y能与氟元素形成YF3,该分子的空间构型是_______,该分子属于______分子(填“极性”或“非极性”)。Y与X可形成具有立体结构的化合物Y2X6,该结构中Y采用______杂化。
(4)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式_______________。
(5) Z的一种单质晶胞结构如下图所示。
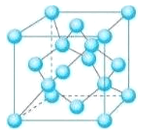
①该单质的晶体类型为___________。
②含1 mol Z原子的该晶体中共有_____mol化学键。
③己知Z的相对原子质量为M,原子半径为r pm,阿伏伽德罗常数的值为NA,则该晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X:可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42-、SiO32-、NO3-中的一种或几种离子,取该溶液进行实验,转化关系如图所示。反应过程中有一种气体在空气中会变为红棕色。回答下列问题:
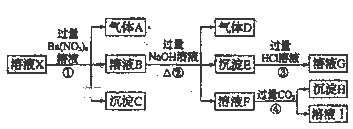
(1)由题给信息可知,溶液X中确定不存在的阴离子有___。
(2)气体A是__(填化学式),产生气体A的离子方程式为__。
(3)步骤④中发生反应的离子方程式为___。
(4)根据题给信息和图中转化关系,可以确定溶液X中肯定存在的离子有__,可能存在的离子有__。检验可能存在的离子是否存在的方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
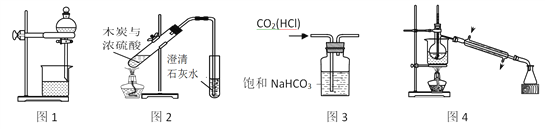
A. 图1用于分离酒精和水
B. 图2用于验证木炭与浓硫酸的反应产物中含有CO2
C. 图3用于除去CO2中的少量HCl
D. 图4用于制备蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于气相反应,用某组分(B)的平衡压强[p(B)]代替物质的量浓度(cB)也可表示平衡常数(记作Kp)。已知反应CH4(g)+2H2O(g)CO2(g)+4H2(g),在t℃时的平衡常数 Kp=a,则下列说法正确的是
A.Kp=![]()
B.升高温度,若Kp 增大,则该反应为吸热反应
C.该反应达到平衡状态后,增大压强,平衡向左移动,Kp减小
D.t℃时,反应![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)![]() CO2(g)+2H2 (g)的平衡常数Kp=
CO2(g)+2H2 (g)的平衡常数Kp=![]() a
a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
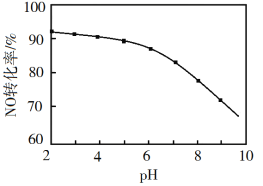
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com